
پتاسیم نیترات (KNO3)
پتاسیم نیترات چیست؟
پتاسیم نیترات ماده ای بلوری و سفید رنگ با فرمول شیمیایی KNO3 است. این ماده مزه ای شور دارد، بنابراین به آن «شوره» نیز می گویند. این محصول غیر سمی و قابل اشتعال است و حلالیت نسبی در آب دارد که با افزایش دما، حلالیت آن بیشتر می شود.
KNO3 یک اکسید کننده نسبتا قوی به شمار می رود. قابلیت جذب آب این ماده باعث شده که در محصولاتی مانند باروت استفاده شود تا در صورت قرارگیری در برابر رطوبت آسیب نبیند. همچنین نیاز مبرم گیاهان به عناصر پتاسیم و نیتروژن، این ماده را از مهم ترین اجزای کودها کرده است.
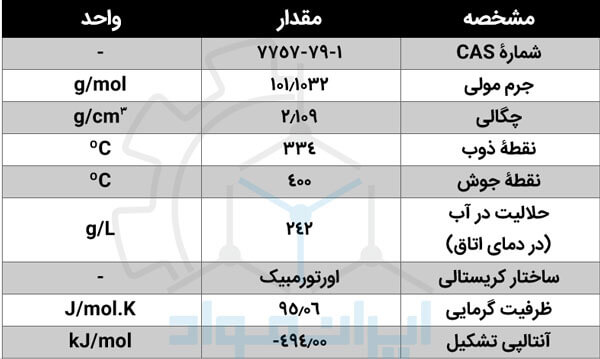
مشخصات فیزیکی و شیمیایی KNO3
فرایند تولید پتاسیم نیترات به چه صورتی است؟
صرف نظر از فرایندهای تولید صنعتی این محصول، این ماده به شکل طبیعی در زمین وجود دارد. این ترکیب به شکل پوسته هایی نازک با رنگ سفید روی تخته سنگ ها، دیوارۀ غازها و انواع خاک هایی که غنی از ماده آلی هستند، تشکیل می شود. منابع طبیعی اصلی KNO3 به در کشورهای هند، اسپانیا، مصر و ایتالیا است.
نیترات پتاسیم صنعتی از اختلاط ترکیبات آمونیوم نیترات و هیدروکسید پتاسیم به دست می آید. در این واکنش آمونیاک نیز به عنوان محصول جانبی تولید می گردد. روش جایگزین برای تولید KNO3 بدون محصول جانبی آمونیاک، ترکیب نیترات آمونیوم و کلرید پتاسیم است. محصولات این روش ، نیترات پتاسیم و کلرید آمونیوم است.
NH4NO3 + KCl ↔ KNO3 + NH4Cl
همچنین این ماده را می توان با خنثی کردن اسید نیتریک با هیدروکسید پتاسیم نیز تولید کرد. البته لازم به ذکر است که این واکنش بسیار گرمازا است و باید در محیط های خاصی انجام شود.
HNO3 + KOH ↔ KNO3 + H2O
تولید نیترات پتاسیم از فضولات کبوتر!
برای تهیه این ماده یک روش ساده تر نیز وجود دارد و آن استفاده از کود کبوتر است. ابتدا باید مقداری کود کبوتر را در ۱۰۰ گرم آب حل کرد. سپس این محلول را درون محفظه ای با در بسته ریخته و برای زمان ۲ ساعت در فریزر برای انجماد کامل قرار داد. در مرحله بعد قالب ماده شیمیایی یخ زده فوق را روی یک پارچه با قابلیت نفوذ مناسب آب می ریزند تا بهطور کامل آب شود.
توجه داشته باشید که به هیچ وجه نباید آب گرم روی یخ گرفته شود! این خطا سبب انحلال بلورهای نیترات پتاسیم می شود. برای به دست آوردن این مادۀ شیمیایی، بعد از آب شدن یخ مذکور، بلور های آن را از روی پارچه جمع آوری می کنند. سپس این بلورها را در محلی گرم قرار می دهند تا کاملا خشک شوند.

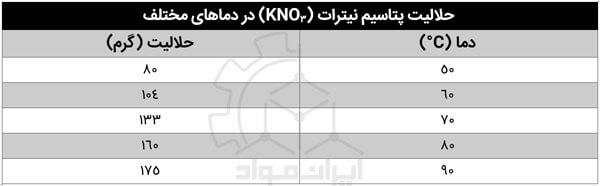
انحلال پذیری در دماهای مختلف
همان طور که گفتیم، KNO3 نیز مثل دیگر نیترات ها با بالا رفتن دما انحلال پذیرتر می شود. افزایش انحلال پذیری این ماده به این صورت است که به ازای هر ۳۰ درجه سلسیوس افزایش دما، انحلال پذیری آن دو برابر می شود! به عنوان مثال انحلال پذیری این ماده در دمای ۵۰ و ۸۰ درجه سلسیوس به ترتیب برابر ۸۰ و ۱۶۰ گرم در ۱۰۰ میلی لیتر آب است.
کاربردهای پتاسیم نیترات
- به عنوان عامل اکسایش در موتورهای موشک و بمب های دودزا
- نگهدارنده مواد غذایی
- ماده ادرار آور در پزشکی
- مادۀ اصلی بسیاری از کودها در باغبانی و کشاورزی
- الکترولیت در پل های نمکی
- مکمل های بدنسازی
- جلوگیری از دوباره سوختن تنباکو در سیگار
- قرص های کمر درد و درد مفاصل در داروسازی
- تولید شیشه های نوری و صنعتی با درجات بالا
- تولید خمیر دندان های مناسب دندان های حساس و اعصاب
- ذخیره سازی حرارتی در سیستم های تولید الکتریسیته

با پتاسیم نیترات شوخی نکنید!
بزرگترین خطر پتاسیم نیترات بلعیدن آن است. این کار باعث مسمومیت حاد می شود که در نهایت سبب مرگ می شود. توجه کنید که سرعت جذب KNO3 توسط دستگاه گوارش بسیار زیاد است. یون پتاسیم به تنهایی سمیت کمی دارد. خاصیت سمی بودن نمک های آن با آنیون آن ها در ارتباط است.
این ماده به خودی خود آتش زایی کمی دارد؛ اما اگر با مواد اشتعال پذیر واکنش دهد موجب افزایش خطر آتش سوزی می شود. در استفاده از این ترکیب یونی به عنوان کاتالیزور، لازم است احتیاط لازم را داشته باشید.
تاکنون در موارد بسیاری استفاده از مقدار زیاد نیترات پتاسیم در آزمایش ها باعث واکنش ناخواسته با مواد احتراقی شده و منجر به انفجارهای مهیب شده است. همچنین اگر این ماده در طولانی مدت در معرض گرمای آفتاب یا هر نوع حرارت دیگری قرار گیرد، خطر انفجار وجود دارد.
خرید و نگهداری نیترات پتاسیم
بسیاری از مراکز فروش مواد شیمیایی، نیترات پتاسیم را به صورت صنعتی و آزمایشگاهی به فروش می رسانند. توجه کنید که قیمت نوع آزمایشگاهی این محصول بالاتر از نوع صنعتی آن است. چرا که پتاسیم نیترات آزمایشگاهی معمولا وارداتی است، خلوص بالاتری دارد، در مقادیر کمتری تولید می شود و هزینۀ بسته بندی و حمل و نقل نیز دارد.
در خرید این محصول، با وجود گستردگی محصولات و وجود برندهای اصلی و غیر اصلی لازم است دقت زیادی انجام دهید. خرید از شرکت ها و فروشگاه های حضوری یا آنلاین که سابقه زیادی در حوزه خرید و فروش مواد شیمیایی داشته باشند، پیشنهاد می شود.










دیدگاه کاربران
اطلاعات عمومی خوبی بود وزیاد از حد تخصصی بهش نپرداختید
پاسخ خواسته من را داده بود ،
سلام. خوشحالیم که مفید واقع شده.