
انواع خوردگی و روش های کنترل آن
خوردگی چیست؟
منظور از خوردگی، تخریب تدریجی یک ماده بر اثر واکنش با محیط اطرافش است. بسیاری از مواد مهندسی شامل فلزات، سرامیکها، پلیمرها و … همواره در معرض خطر خورده شدن قرار دارند. حتما بارها زنگزدن فلزاتی که در معرض آب و یا هوا قرار دارند را دیدهاید، این مثال یکی از متداولترین نمونههای خوردگی در فلزات است. خوردگی در فلزات معمولا یک فرآیند الکتروشیمیایی است، یعنی عموما خوردگی فلزات به واسطه واکنش شیمیایی فلز با محیطش اتفاق نمیافتد، بلکه اغلب نتیجه وقوع زوج واکنشهای الکتروشیمیایی و مبادله الکترون است. در بخشهای بعد با انواع خوردگی و نحوه انجام واکنش های آن آشنا خواهیم شد.
چرا باید خوردگی را جدی بگیریم؟
اهمیت خوردگی را میتوانیم در سه کلمه خلاصه کنیم: اقتصاد، ایمنی و حفاظت. در صورتی که از بروز این پدیده جلوگیری نکنیم، هزینههای مستقیم و غیر مستقیم سنگینی به ما تحمیل خواهد شد. مثلا فرض کنید لولهای در یک پالایشگاه در اثر خوردگی دچار از کار افتادگی شده و باید تعویض گردد. در این شرایط ممکن است هزینه تعویض لوله در نگاه اول چندان زیاد به نظر نرسد، اما در نظر داشته باشید که تعطیلی خط تولید در هر ساعت، هزاران برابر هزینه تعویض لوله به آن مرکز خسارت وارد میکند. به همین دلیل، ملاحظات اقتصادی همواره یکی از مهمترین انگیزههای بشر برای گسترش علم خوردگی بوده است.
علاوه بر جنبههای اقتصادی، انهدام ناگهانی سازهها در اثر وقوع انواع خوردگی میتواند جان هزاران نفر را به خطر بیندازد. ریزش پلهای بزرگ در طول تاریخ به خاطر خوردگی، بارها باعث سقوط افراد و مرگ آنها شده است. در سال 1988 کابین یک هواپیما در کانادا در آسمان متلاشی شد و تمامی مسافران آن جان خود را از دست دادند. انفجار لولههای گاز در اثر خوردگی نیز از جمله حوادث فاجعهباری است که متاسفانه هنوز هم سهم بسیار زیادی را در حوادث به خود اختصاص میدهد. تمام این دلایل باعث میشوند مهندسین حوزه خوردگی با درک هر چه بیشتر مکانیزمهای وقوع خوردگی در شرایط مختلف، از وقوع حوادث و هدر رفتن هزینهها جلوگیری کنند. در همین راستا، کشورهای صنعتی سالانه میلیاردها دلار صرف هزینههای جلوگیری از وقوع خوردگی میکنند.

خوردگی در فلزات چگونه اتفاق میافتد؟
همانطور که گفتیم، خوردگی در بسیاری از فلزاتی که در مجاورت با محیط خورنده قرار میگیرند، بر اثر انجام یک سری واکنشهای الکتروشیمیایی اتفاق میافتد. به طور کلی در واکنشهای الکتروشیمیایی دو نیم واکنش به صورت همزمان انجام میشوند. در یک واکنش الکترون تولید و در دیگری مصرف میشود. برای این که واکنش خوردگی اتفاق بیفتد باید یک مدار کامل الکتروشیمیایی داشته باشیم.
عناصر تشکیل دهنده مدار الکتروشیمیایی شامل کاتد (جزء مصرف کننده الکترون)، آند (جزء دهنده الکترون) و مسیر انتقال الکترون هستند. در سیستمهای خوردگی مسیر انتقال الکترون همان الکترولیت و به عبارتی محیط خورنده است. اگر هر کدام از این عناصر وجود نداشته باشند فرآیند خوردگی اتفاق نخواهد افتاد. در تصویر زیر می توانید این واکنش ها را در اثر قرارگیری فلز در یک محیط خورنده اسیدی مشاهده کنید.
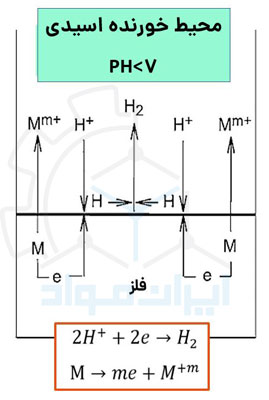
واکنش آندی در خوردگی
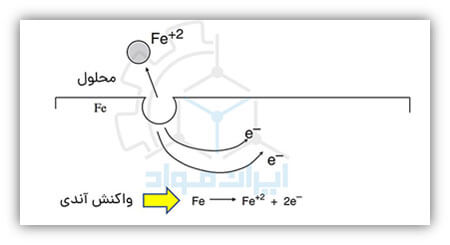
در علم خوردگی، به واکنشی که در آن الکترون تولید می شود، واکنش آندی می گوییم. در فرایند خوردگی فلزات، واکنش آندی در واقع همان واکنش از دست رفتن و به عبارتی انحلال فلز است. این واکنش دو خصوصیت اصلی دارد:
- فلز تحت فرآیند اکسیداسیون قرار میگیرد و عدد اکسایش آن زیاد میشود.
- در آن الکترون تولید میشود.
در تصویر زیر می توانید واکنش خورده شدن فلز آهن را در یک محیط خورنده به واسطه انجام واکنش آندی ملاحظه کنید.
اما آیا هر واکنش آندی نشانه واکنش خوردگی است؟
شرط این که یک واکنش آندی مربوط به فرآیند خوردگی یک فلز باشد، این است که در آن واکنش شاهد از دست رفتن فلز باشیم. برای درک بیشتر به واکنشهای زیر نگاه کنید.
Cr3+(aq) + 4H2O → CrO42-(aq) + 8H+(aq) + 3e–
Fe(CN)64-(aq) → Fe(CN)63-(aq) + e–
هر دو واکنش زیر از نوع واکنشهای آندی هستند یعنی طی آنها الکترون تولید شده است، اما این واکنشها مربوط به فرآیند خوردگی نیستند زیرا نشانهای از انحلال فلز در آنها نیست.
واکنش کاتدی در خوردگی
برای وقوع خوردگی، همزمان با انجام واکنش آندی، واکنش کاتدی نیز باید اتفاق بیفتد. واکنش کاتدی واکنشی است که طی آن الکترون مصرف میشود و بسته به نوع محیط میتواند متفاوت باشد. به عنوان مثال در یک محیط اسیدی عموما نیم واکنش احیای تولید هیدروژن (HER) و در یک محیط بازی، نیم واکنش احیای یون اکسیژن (ORR)، واکنشهای کاتدی هستند.
واکنش کاتدی نیز همانند واکنش آندی دو ویژگی اصلی دارد:
- گونه شرکت کننده در این واکنش احیا میشود و عدد اکسایش آن کاهش مییابد.
- در این واکنش الکترون مصرف میشود.
احتمالا بارها حبابهای گازی را که بر سطح یک فلز در آب ایجاد میشوند، دیدهاید. دلیل ایجاد این حبابها انجام یک واکنش کاتدی است که در آن یونهای هیدروژن محلول در آب با گرفتن الکترون تبدیل به مولکولهای گازی هیدروژن در سطح فلز میشوند. در تصویر زیر نحوه انجام این واکنش نشان داده شده است.
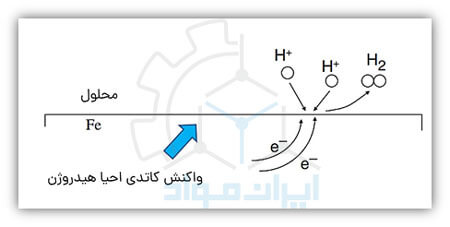
در تصویر زیر میتوانید مجموعهای از مهمترین واکنشهای کاتدی را که در محیط های خورنده مشاهده می شوند، ملاحظه کنید.
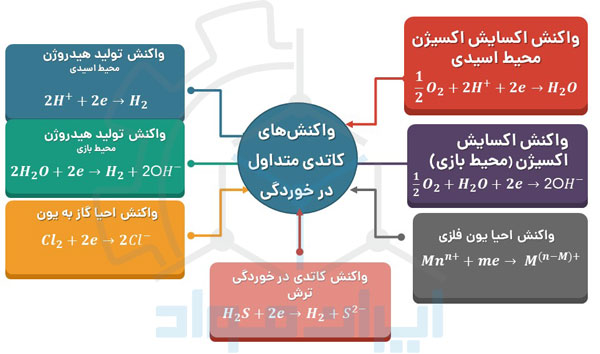
دقت داشته باشید که واکنش های خوردگی به صورت همزمان اتفاق می افتند!
زمانی که یک فلز در حال خوردگی است، مجموعهای از واکنشهای آندی و کاتدی که درباره آنها صحبت کردیم، در نقاط مختلف سطح آن به صورت همزمان انجام میشوند. به تصویر زیر نگاه کنید:
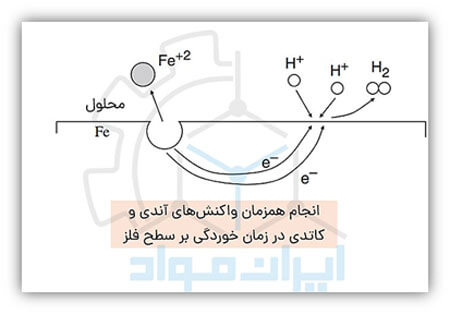
به محلی که واکنش آندی و حل شدن فلز انجام می شود، آند و به محلی که واکنش کاتدی در آن صورت میگیرد، کاتد میگوییم. همانطور که در تصویر بالا میبینید، در خورده شدن یک فلز (در اینجا فلز آهن) با انحلال فلز و تولید الکترون، این الکترونها در منطقهای دیگری در سطح فلز برای انجام واکنش کاتدی مصرف میشوند. این که آندها و کاتدهای ایجاد شده در سطح یک فلز از هم دور باشند یا در فواصل نزدیک باشند، از عوامل مهمی است که در تعیین نوع خوردگی نقش دارد.
دلیل شروع واکنش الکتروشیمیایی از سطح فلز چیست؟
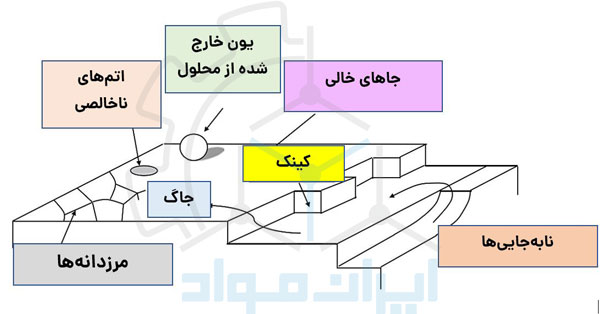
سطح فلزات ناهمگن است. این ناهمگنی باعث ایجاد تفاوت انرژی در نقاط مختلفی از سطح فلز می شوند. وجود مرزدانه، عیوب ناشی از نابهجاییها (مانند جاگ و کینک) و همچنین عناصر ناخالصی که در سطح فلز هستند، این مناطق خاص را به مناطقی با انرژی بالاتر نسبت به اطراف تبدیل میکنند. اتمهای فلزی که در این نقاط قرار میگیرند، تمایل پیدا میکنند که جدا شده و در محلول حل شوند. بنابراین به همین صورت در مناطق زیادی در سطح فلز واکنشهای آندی و کاتدی آغاز میشوند. در کل، نیروی محرکه بیشتر انواع فرآیندهای خوردگی اختلاف در میزان انرژی و به عبارتی اختلاف پتانسیل بین دو منطقه از سطح قطعه است. تصویر زیر مجموعهای از این عیوب میکروسکوپی را نشان می دهد که عاملی برای ایجاد خوردگی در سطح فلز هستند.
قانون فارادی را در خوردگی به خاطر بسپارید!
همانطور که گفته شد، خوردگی فرآیندی است که همزمان انتقال بار الکتریکی (الکترون) و انقال جرم (یون ها) در آن نقش دارند. قانون فارادی یکی از روابط بنیادینی است که انتقال بار الکتریکی و میزان خوردگی را به هم مرتبط میکند. بر اساس این رابطه میتوان جرمی از ماده که خورده میشود را بر اساس بار مبادله شده محاسبه نمود. در این رابطه W میزان خوردگی فلز ، I جریان الکتریکی، t زمان، A سطح نمونه، n عدد انتقال بار و F ثابت فارادی است که برابر 96500 کولن است.
![]()
حال ممکن است در ذهنتان سوال شود که این رابطه چه کاربردی دارد؟
با استفاده از این رابطه میتوان سرعت خوردگی یک سیستم را گزارش کرد. در واقع، در هر سیستم خوردگی با دانستن جریان الکتریکی که در آن خوردگی ایجاد شده است (جریان خوردگی) میتوان سرعت خوردگی را بر اساس واحد مقدار ماده از دست رفته در واحد سطح در واحد زمان گزارش کرد. پس :

در رابطه فوق، z تعداد الکترون مبادله شده در واکنش است.
با چه روشهایی میتوانیم سرعت خوردگی را محاسبه کنیم؟
روشهای مختلفی برای محاسبه سرعت خوردگی یک ماده وجود دارد. به طور کلی، میتوان سرعت خوردگی را با انجام آزمونهای الکتروشیمیایی یا با روشهای غیر الکتروشیمیایی تعیین کرد.
روشهای الکتروشیمیایی بر مبنای الکترونهای مبادله شده در سیستم، جریان خوردگی را اندازهگیری میکنند و بر مبنای آن در نهایت سرعت خوردگی محاسبه میشود. این روشها شامل آزمونهایی مانند پلاریزاسیون، آزمون امپدانس و … میشوند.
در روشهای غیر الکتروشیمیایی، سرعت خوردگی یک ماده را میتوان بر اساس مقدار کاهش وزن فلز، میزان یون فلزی وارد شده به محلول، میزان گاز خارج شده و یا تغییر ضخامت نمونه محاسبه کرد.

سرعت خوردگی را با چه واحدی گزارش کنیم؟
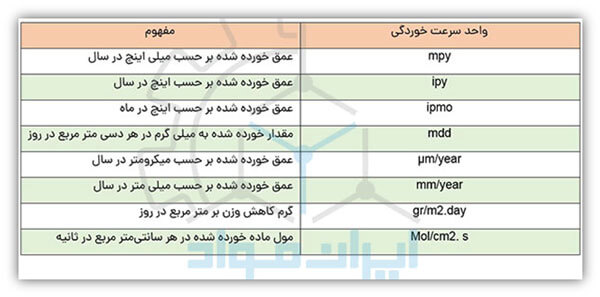
در میان روشهای مختلف گزارش سرعت خوردگی، واحد mpy متداولترین روش گزارش سرعت خوردگی است. این واحد بیان میکند که چند میلیاینچ از عمق ماده در یک سال خورده شده است. علت محبوبیت این واحد هم همین است که سرعت خوردگی را بر حسب عمق نفوذ با ارقام صحیح و کوچک نشان میدهد. واحدهای دیگری نیز برای گزارش سرعت خوردگی وجود دارند و همگی قابل تبدیل به هم هستند. در جدول زیر برخی از مهم ترین این واحدها را مشاهده می کنید.
حال برویم سراغ معرفی انواع خوردگی …
تا اینجا احتمالا تا حد خوبی به این درک رسیدهاید که پدیده خوردگی چرا و چگونه آغاز میشود. در این بخش میخواهیم شما را با انواع خوردگی نیز آشنا کنیم. عموما انواع خوردگی بر اساس ظاهر خوردگی دستهبندی میشوند. بر این اساس، انواع خوردگی را می توان در دو گروه خوردگی یکنواخت و خوردگی موضعی (غیر یکنواخت) تقسیم بندی کرد.
خوردگی یکنواخت
خوردگی یکنواخت معمولیترین و متداولترین نوع خوردگی است. این خوردگی معمولا به وسیله یک واکنش شیمیایی یا الکتروشیمیایی به صورت یکنواخت در سرتاسر سطحی که در معرض محیط خورنده قرار دارد، اتفاق میافتد. شما بارها این نوع خوردگی را زمانی که در حال قدم زدن در خیابان هستید، دیدهاید! زنگ زدن و خورده شدن میز و نیمکت پارکها یکی از مثالهای این نوع خوردگی است. این خوردگی به سادگی تشخیص داده میشود و میتوان به راحتی جلوی آن را گرفت، بنابراین در بسیاری از موارد تهدید جدی به حساب نمیآید.
خوردگیهای موضعی (غیر یکنواخت)
این نوع از خوردگی، به صورت غیر یکنواخت در سطح فلز اتفاق می افتد و می توان آن را در 8 دسته کلی جای داد:
- خوردگی گالوانیک
- خوردگی شیاری
- خوردگی حفرهای
- خوردگی بیندانهای
- خوردگی انتخابی
- خوردگی فرسایشی
- خوردگی مکانیکی
- خوردگی میکروبی

خوردگی گالوانیک (Galvanic Corrosion)
این خوردگی زمانی اتفاق میافتد که دو فلز غیر همجنس در تماس با یکدیگر، در معرض محیط خورنده باشند. در این حالت فلزی که مقاومت بیشتری در برابر خوردگی دارد، کاتد و فلزی که مقاومت کمتری دارد، آند میشود و به شدت خورده میشود. نیروی محرکه در شروع این نوع خوردگی، اختلاف پتانسیلی است که بین این دو فلز وجود دارد.
خوردگی گالوانیک (خوردگی دوفلزی)
بسیاری از اتصالات مورداستفاده در صنعت در معرض شرایط نامساعد جوی قرار دارند. اگر ...خوردگی شیاری (Crevice corrosion)
این نوع خوردگی عموما در داخل شیارها و نواحی از سطح فلز که الکترولیت در آن به دام می افتد، رخ می دهد. احتمالا تاکنون بارها این تجربه را داشته اید که وقتی یک قوطی فلزی را بر روی سطحی مانند کاشی میگذارید، بعد از مدتی اثر زنگ زدن کف قوطی بر روی زمین میماند. این موضوع به این خاطر است که در منطقه بین قوطی و زمین یک شیار کوچک ایجاد میشود و آب میتواند در آن به دام بیفتد و باعث تشدید خوردگی شود.
خوردگی حفرهای (Pitting corrosion)
خوردگی حفرهای یکی از شدیدترین و مخربترین انواع خوردگی موضعی است که میتواند باعث سوراخ شدن فلز شود. حفراتی که در اثر این نوع خوردگی بر روی سطح فلز ایجاد میشوند، غالبا بسیار ریز هستند و نمیتوان به سادگی آنها را تشخیص داد. بنابراین معمولا این خوردگی به صورت ناگهانی آشکار میشود و زمانی که تشخیص داده میشود، معمولا کار از کار گذشته است و خسارات زیادی را به بار آورده است!
خوردگی بیندانهای (Intergranular corrosion)
این خوردگی زمانی اتفاق میافتد که مرزدانهها یا نواحی نزدیک آن در حالی که خود دانهها خورده نشدهاند، شروع به خورده شدن میکنند. در نتیجه این نوع خوردگی، فلز یا پودر میشود یا استحکام خود را تا حد زیادی از دست میدهد. خوردگی در مرزدانهها معمولا بر اثر جدایش عناصر و ناخالصیها در مرزها و یا غنی شدن یا فقیر شدن مرز نسبت به یک عنصر مهم اتفاق میافتد.
خوردگی انتخابی (Selective Corrosion)
خوردگی انتخابی در اثر حل شدن انتخابی یک جزء فعال از درون آلیاژ اتفاق میافتد. یکی از معروفترین مثالهای این خوردگی جدایش روی در آلیاژهای برنج است.
خوردگی سایشی (Erosion Corrosion)
خوردگی سایشی، خورده شدن فلزات در برابر حرکت نسبی یک سیال خورنده است. در اکثر موارد، تخریبهای ناشی از این خوردگی به طور غیر منتظره و در زمانهای کوتاهی اتفاق میافتد. خوردگی پروانه یک پمپ که دائما در برابر حرکت یک مایع قرار دارد، مثالی از این نوع خوردگی است.
خوردگی مکانیکی (Mechanical Corrosion)
خوردگی توام با تنش، یکی از انواع خوردگی است که در اثر همکاری همزمان تنش و محیط خورنده اتفاق میافتد. این نوع خوردگی خود به انواع مختلفی تقسیم می شود. خوردگی SCC، خوردگی فرسایشی (fretting corrosion)، خوردگی خستگی و … جزء این گروه حساب میشوند.
خوردگی میکروبی (Microbial corrosion)
این خوردگی در اثر فعالیت موجودات ریز مانند باکتریها اتفاق میافتد. در واقع میکروبها از طریق مکانیزمهایی مانند تولید اسید، مصرف اکسیژن و … باعث به وجود آمدن شرایط مناسب برای تشدید خوردگی میشوند. این نوع خوردگی در بسیاری از صنایع از جمله صنایع نفت، پتروشیمی و کارخانههای تولید کننده مواد شیمیایی و مواد غذایی دیده میشود.
چگونه با خوردگی مقابله کنیم؟
مهندسین خوردگی عموما در دو راستا نسبت به کاهش حوادث ناشی از خوردگی اقدام میکنند:
- کنترل خوردگی: اقداماتی که برای جلوگیری و به حداقل رساندن وقوع خوردگی صورت میگیرد. به عنوان مثال میتوان به انتخاب مواد مقاومتر، تغییر در نوع طراحی و تکنیکهای پوششدهی اشاره کرد.
- پایش خوردگی: نظارت و بررسی مداوم تجهیزات که به منظور تشخیص سریع خوردگی و اقدام به موقع صورت میگیرد. این اقدام نیازمند بازرسی مداوم تجهیزات در حین کار، نمونهگیری، انجام آزمایش و کنترل تغییرات پارامترهای محیطی است.

نتیجهگیری
در این مقاله با انواع خوردگی و اهمیت پیشگیری و کنترل آشنا شدیم. خوردگی عموما به دلیل وقوع مجموعهای از واکنشهای الکتروشیمیایی در فلزات صورت میگیرد. خوردگی موضعی در فلزات خطرناکترین نوع خوردگی است و در صورت وقوع آن، ممکن است به طور غیر منتظرهای سازه منهدم گردد. با وجود قدرتی که خوردگی در تخریب مواد دارد، اما با درک مناسب از مکانیزمها و واکنشهای آن، قادر خواهیم بود اقدامات مناسبی جهت پیشگیری و کنترل آن انجام دهیم.
دانلود فقط با IP ایران امکانپذیر است. در صورت عدم مشاهده باکس قرمز رنگ دانلود، VPN خود را خاموش نموده و صفحه را رفرش کنید.
پسورد فایل فشرده : www.iran-mavad.com











دیدگاه کاربران
سلام
آیا روشهای حفاظت از خوردگی بومی سازی شده اند؟ هزینه تجهیزات لازم برای حفاظت از خوردگی سالانه چقدر است؟
میشه تعیین سرعت خوردگی رو بر اساس رهایش یون در محلول که در متن به این صورت آورده شده رو (در روشهای غیر الکتروشیمیایی، سرعت خوردگی یک ماده را میتوان بر اساس مقدار کاهش وزن فلز، میزان یون فلزی وارد شده به محلول، میزان گاز خارج شده و یا تغییر ضخامت نمونه محاسبه کرد.) توضیح بدید و بگید روشش به چه صورت هست؟
سلام و درود 🙂
در این روش برای اندازه گیری سرعت خوردگی نمونههای فلزی را درون محلول خورنده مورد نظر قرار میدهید و در بازه های زمانی مختلف باید غلظت یون فلزی وارد شده به محلول را اندازه گیری کنید. چرا که غلظت یون فلز وارد شده در محلول نشان دهنده میزان فلز خورده شده است.
به این منظور باید نمونه را از محلول خورنده خارج کرده سطح آن را با ابزاری چون مسواک تمیز کنید. فقط دقت داشته باشید که باید محصولاتی که بر روی مسواک می چسبند را مجددا درون محلول وارد کنید (با تکاندن مسواک در محلول این کار را انجام دهید)، زیرا ممکن است مقداری از یون فلزی که بر اثر خوردگی وارد محلول شده اند به صورت محصولات خوردگی بر روی سطح فلز قرار گرفته باشند. پس از آن باید از محلولی که نمونه در آن قرار داشته یک نمونه تهیه کنید و معمولا در این مرحله مقداری اسید ( اسید نیتریک یا هیدروکلریک اسید و … بسته به نوع فلز) به محلول اضافه می کنیم تا تمامی ترکیبات و رسوبات جامد در محلول حل شوند. در نهایت نمونه های تهیه شده از محلول آنالیز شیمیایی میشوند ( مثلا AAS جذب اتمی که دقت آن در حد ppm) تا غلظت یون فلزی در آن تعیین گردد. پس از آن میتوان با رسم نمودار غلظت یون فلزی وارد شده به محلول بر حسب زمان از روی شیب نمودار سرعت خوردگی را محاسبه نمود.