 جدید
جدیدقوانین ترمودینامیک به ساده ترین زبان ممکن!
قانون ترمودینامیک ، مقادیر فیزیکی مانند دما، انرژی و آنتروپی را تعریف می کند. این مقادیر نیز سیستم های ترمودینامیکی را در حالت تعادل ترمودینامیکی توصیف می کنند.
کارایی اصلی هر قانون ترمودینامیک، تعریف روابط بین این مقادیر است. به علاوه، این اصول مبنایی برای غیرممکن بودن وجود پدیده هایی خاص مانند حرکت ابدی (perpetual motion) ارائه می دهند.
این قوانین، فقط مخصوص به ترمودینامیک نیستند و قوانین بنیادین در فیزیک عمومی نیز به شمار می روند. همچنین در سایر علوم طبیعی نیز کاربردهای زیادی دارند.
ترمودینامیک در ابتدا سه قانون اساسی داشت که به شکلی ساده، با عناوین قانون اول، قانون دوم و قانون سوم به رسمیت شناخته شدند. اما پس از انتشار و تصویب سه قانون اول، مشخص شد که یک اصل بنیادی برای هر سه قانون اساسی نیاز است. این قانون ترمودینامیک نیز پس از انتشار، قانون صفرم (zeroth law) نامیده شد.
قوانین ترمودینامیک از کجا به وجود آمدند؟
«کنت رامفرد» در سال 1797 ادعا کرد که مقدار محدودی کار، می تواند یک فعالیت مکانیکی بی پایان و به دنبال آن مقادیر زیادی گرما تولید کند. این ادعا، تئوری کالُریک گرما را به چالش کشید. اساس تئوری کالریک، این بود که یک مقدار محدود کار، فقط می تواند مقدار محدودی گرما تولید کند. در راستای بررسی ایدۀ رامفرد، آزمایشات تئوری و تجربی زیادی انجام گرفت.
تا آن جا که اولین قانون ترمودینامیک (از لحاظ تاریخی) که بعدها تبدیل به قانون دوم شد، توسط «لئونارد کارنو» در سال 1824 تنظیم و فرموله شد. سپس در سال ۱۸۶۰، در آثار دانشمندانی مانند «رودولف کلازیوس» و «ویلیام تامسون» قوانین اول و دوم ترمودینامیک کاملا اثبات شدند.
در سال 1873 «ویلارد گیبس» در کتاب Graphical Methods in the Thermodynamics of Fluids، به وضوح در مورد این دو قانون ترمودینامیک صحبت کرد و آن ها را تایید کرد.
در اواخر قرن بیستم این قوانین دستخوش تغییراتی قرار گرفتند تا به بیان امروزی خود برسند. قوانین صفرم و سوم ترمودینامیک نیز محصول همین سال ها و تحقیقات جدیدتر دانشمندان هستند. در ادامه، مفاهیم مورد نیاز برای درک قوانین ترمودینامیک را بررسی می کنیم. سپس قوانین ترمودینامیک را بیان می کنیم.
آشنایی با مفاهیم پایه علم ترمودینامیک
انرژی حرارتی (Thermal energy)
انرژی حرارتی، نوعی از انرژی است که یک سیستم با توجه درجه حرارتش دارد. این انرژی می تواند از یک سیستم به یک سیستم دیگر به صورت گرما منتقل شود. به عبارت دیگر، وقتی انرژی حرارتی بخواهد منتقل شود، در قالب گرما منتقل می شود.
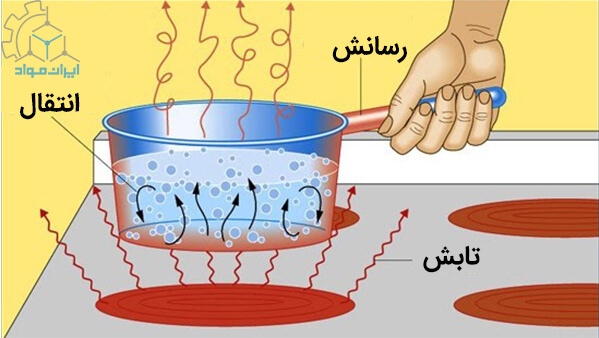 در این شکل مشاهده می کنیم که تحرک ذرات مایع، منجر به افزایش انرژی حرارتی می شود. این انرژی در قالب گرما و با مکانیزم های مختلف، انتقال می یابد.
در این شکل مشاهده می کنیم که تحرک ذرات مایع، منجر به افزایش انرژی حرارتی می شود. این انرژی در قالب گرما و با مکانیزم های مختلف، انتقال می یابد.
در هر قانون ترمودینامیک، ممکن است با مفهوم انرژی حرارتی برخورد کنید. منشأ این انرژی، تحرک و لرزش مولکول ها و ذرات ماده و برهمکنش آن ها باهم است. در واقع، انرژی حرارتی سیستم، به نوعی مجموع این برهمکنش ها است و به مقیاس اتمی نگاه نمی کند.
در هر حال، رسیدن به درک درستی از این برهمکنش ها، اصلا آسان نیست. پروفسور «دیوید مک کی» از دانشگاه ایالتی میسوری آمریکا، در این باره می گوید:
«سیستمی که ما در مورد آن حرف می زنیم، از تعداد زیادی اتم و مولکول تشکیل می شود که به طریقی بسیار پیچیده برهمکنش دارند. اما ما نباید تسلیم شویم. ما می توانیم حالت تعادل ترمودینامیکی را در نظر بگیریم و محاسبات را بسیار ساده تر کنیم.»
تعادل ترمودینامیکی (Thermodynamic equilibrium)
تعادل ترمودینامیکی، شاید یکی از مهم ترین مفاهیمی باشد که در درک هر قانون ترمودینامیک، کارآمد است. تعادل ترمودینامیکی، مفهومی بدیهی (axiomatic concept) است که می تواند صرفا برای درون یک سیستم مجزای ترمودینامیکی تعریف شود یا این که با در نظر گرفتن چند سیستم مرتبط مورد بررسی قرار گیرد.
به طور کلی، تعادل ترمودینامیکی عبارتست از شرایطی که هیچ جریان ماکروسکوپیکی از ماده و انرژی، چه در درون سیستم و چه میان سیستم ها وجود نداشته باشد. سیستم هایی که در تعادل ترمودینامیکی متقابل هستند، در تعادل حرارتی، مکانیکی، شیمیایی و تابشی هستند. اگر چه سیستم ها ممکن است بسته به شرایط، فقط یکی از این تعادل ها را تجربه کنند. یک سیستم در این حالت، در تمام نقاط خود دمای یکسانی دارد.
شرایط تعادل ترمودینامیکی عبارتند از:
- برای سیستم ایزوله، آنتروپی حداکثر است.
- برای سیستمی با حجم و دمای ثابت، انرژی آزاد هلموهلتز (A) حداقل است.
- برای سیستمی با حجم و فشار ثابت، انرژی آزاد گیبس (G) حداقل است.
گرما (Heat)
هر قانون ترمودینامیک نوع خاصی از انرژی را مورد بررسی قرار می دهد. گرما نوعی از انرژی است که بین دو سیستم، به علت اختلاف دمای موجود، مبادله می شود. بنابراین این کمیت، تابع مسیر است.
گرما خود به خود به وجود نمی آید و هیچوقت از بین نمی رود. گرما یا باید از جایی به جای دیگر منتقل شود و یا به حالت دیگری از انرژی تبدیل شود. برای مثال، یک توربین بخار گرما را به انرژی جنبشی تبدیل می کند. انرژی جنبشی ژنراتوری را به حرکت در می آورد و ژنراتور انرژی الکتریکی تولید می کند.
یک لامپ، این انرژی را به تابش الکترومغناطیسی (نور) تبدیل می کند. حال وقتی این نور، توسط یک سطح جذب شود، دوباره به گرما تبدیل می شود. خواهیم دید که تبادل گرما در قوانین ترمودینامیک از اهمیت ویژه ای برخوردار است. معمولا این پارامتر را با حرف Q نشان می دهند.
انرژی درونی (Internal energy)
محفظه ای پر از گاز نیتروژن را در نظر بگیرید. نیتروژن یک مولکول دو اتمی با مُد (mode) های حرکتی ارتعاشی و چرخشی است. اگر به این سیستم گرما داده شود، بخشی از این انرژی، به تحریک این مدها و افزایش انرژی حرارتی سیستم منجر می شود.
به انرژی که متعلق به خود مولکول ها و ذرات سیستم است و فقط در مقیاس اتمی و مولکولی می تواند در نظر گرفته شود، انرژی درونی می گویند.
بنابراین، انرژی درونی به انرژی پتانسیل و جنبشی ذرات در مقیاس میکروسکوپیک نگاه می کند. در حالی که انرژی حرارتی به سیستم نگرش ماکروسکوپیک دارد. تغییرات انرژی درونی سیستم را با ΔU نشان می دهند.
دما (Temperature)
مقدار گرمایی که توسط یک سیستم منتقل می شود، بستگی به سرعت و تعداد ذرات شرکت کننده در این انتقال دارد. هر چه ذرات یک سیستم سریع تر حرکت کنند، درجه حرارت یا دمای سیستم بالاتر خواهد بود. از این رو گرمای بیشتری نیز انتقال پیدا می کند.
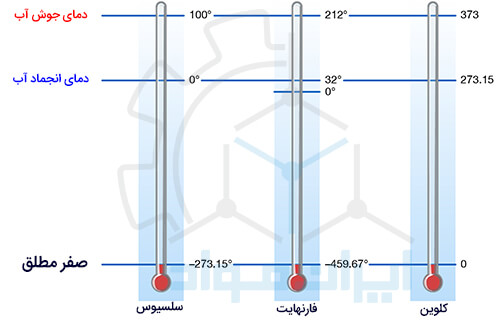
دما مقیاسی از میانگین انرژی جنبشی ذرات یک سیستم است که بر حسب درجه هایی استاندارد واحد بندی می شود. بنابراین تابع حالت است و وابستگی به سابقه قبلی سیستم ندارد. مهم ترین واحد دما، سلسیوس (Celsius) است که بر اساس دمای انجماد و جوش آب (از صفر تا 100 درجۀ سلسیوس) مقیاس بندی شده است. فراموش نکنید که استفاده از واژۀ سانتیگراد برای گزارش دما، اشتباه است!
واحد فارنهایت (Fahrenheit) دیگر واحد مهم گزارش دماست. این واحد نیز بر اساس نقطه جوش و انجماد آب، از 32 تا 212 فارنهایت درجه بندی شده است.
واحد دیگری که توسط دانشمندان در سرتاسر جهان استفاده می شود، کلوین (Kelvin) است. درجه بندی کلوین، دقیقا بهره ای برابر با درجه های سلسیوس دارد. یعنی یک درجۀ سلسیوس، برابر یک درجۀ کلوین است.
صفر مطلق (Absolute Zero)
درجه کلوین از صفر مطلق آغاز می شود. در این دما تمام حرکات مولکولی می ایستند و ذرات هیچ تحرکی ندارند. بنابراین سیستم هیچ گرمایی هم ندارد. دمای صفر کلوین برابر است با 459.67 فارنهایت، یا 273.15 درجه سلسیوس. در ادامه خواهیم دید که صفر مطلق نیز در قوانین ترمودینامیک کاربرد ویژه ای دارد.
قانون سرمایش نیوتن (Newton’s Law of Cooling)
آیزاک نیوتن، در سال 1701 در مقاله ای کوتاه با نام Scala graduum Caloris یکی از مهم ترین قانون های فیزیک را بیان کرد. این قانون در عین سادگی، اساس بسیاری از تحقیقات بعدی در این زمینه شد.
این قانون بیان می کند:
«نرخ تغییرات دمای یک سیستم، متناسب است با اختلاف دمای میان سیستم و محیط اطرافش. این موضوع، منجر به کاهش نمایی (exponential decay) در اختلاف دما خواهد شد.»
برای مثال اگر یک جسم گرم را در یک حمام آب سرد قرار دهیم، در مدت زمانی مشخص، اختلاف دمایی میان جسم و محیط اطرافش به نصف کاهش می یابد. با گذشت همین مدت زمان، اختلاف دمایی باقی مانده نیز نصف می شود. این روند ادامه می یابد تا این که هیچ اختلاف دمایی میان جسم و محیط باقی نماند.
گرمای ویژه (Specific heat)
مقدار گرمایی که برای افزایش دمای مشخصی از جرم مشخصی از یک ماده لازم است را گرمای ویژه یا ظرفیت گرمایی یا ظرفیت گرمایی ویژه می گویند. مهم ترین واحدی که برای گزارش گرمای ویژه به کار می رود، cal/g.K است. عبارت cal نشان دهندۀ کالری است.
یک کالری مقدار انرژی گرمایی لازم برای افزایش دمای یک گرم آب از 4 درجه سلسیوس به 5 درجه سلسیوس است. گرمای ویژه یک نمونه فلزی، تا حد زیادی بستگی به تعداد اتم هایش دارد. برای مثال، یک کیلوگرم آلومینیوم، هفت برابر یک کیلوگرم سرب، گرما جذب می کند.
هدایت حرارتی (Thermal conductivity)
نرخ گذردهی گرما از یک ماده مشخص را هدایت حرارتی (k) می نامند. به عبارتی، مقدار گرمایی که در واحد زمان، از واحد یک سطح با گرادیان دمایی می گذرد، هدایت حرارتی است. واحد این کمیت، W/m.K است.
مقادیر k برای فلزاتی مانند مس و نقره بالاست. این فلزات به ترتیب 410 و 428 W/m·K هدایت حرارتی دارند. این خصوصیت، این مواد را برای رادیاتور ماشین یا کولرِ چیپ های کامپیوتری کارآمد می کند. چرا که این مواد می توانند بسیار سریع، مقدار زیادی گرما را از سیستم مورد نظر دریافت کنند و با محیط اطراف مبادله کنند.
بیشترین هدایت حرارتی را در میان مواد، الماس با 2200 W/m·K دارد. البته بسیاری مواد دیگر عایق حرارتی هستند. خاصیت مقاومت حرارتی را با R-value نشان می دهند. موادی با خاصیت عایق حرارتی، مانند Styrofoam ها، برای پوشش های ساختمانی و صرفه جویی در انرژی، بسیار مناسب هستند.
کار (Work)
کار انجام شده توسط یک سیستم ترمودینامیکی، انرژی منتقل شده توسط سیستم به محیط اطراف خود است. این انتقال انرژی به وسیلۀ مکانیزمی انجام می شود که از طریق آن سیستم می تواند به طور خود به خود نیروهای ماکروسکوپیک را در محیط خود اعمال کند. به طوری که نیروها و تاثیرات خارجی آن ها را بتوان اندازه گیری کرد. کار (W) تابع مسیر است و به سابقه سیستم بستگی دارد.
آنتالپی (Enthalpy)
آنتالپی یک سیستم ترمودینامیکی، محصول انرژی درونی آن و شرایط فشار و حجم سیستم است. از دیدگاه تغییرات، گرمایی که در یک تحول یا واکنش در فشار ثابت مبادله می شود را تغییرات آنتالپی می نامند.
تغییرات آنتالپی (ΔU) مانند انرژی داخلی، تابعی از حالت سیستم و مستقل از سابقه فرایند است. آنتالپی یک نوع انرژی است، بنابراین واحد اندازه گیری آن نیز مانند انرژی، ژول یا اِرگ است.
آنتروپی (Entropy)
تمام سیستم های ترمودینامیکی، گرمای اضافی تولید می کنند. این گرمای اضافی، سبب افزایش آنتروپی می شود. آنتروپی برای یک سیستم بسته، عبارت است از مقدار انرژی حرارتی که برای ایجاد کار در دسترس نیست.
در یک سیستم بسته، آنتروپی همیشه روند افزایشی دارد و هیچگاه کم نمی شود. یعنی تمایل سیستم، همواره به سمت آنتروپی زیاد است. در بعضی منابع، آنتروپی را میزان بی نظمی (disorder) و تصادفی بودن (randomness) سیستم نیز تعریف می کنند.
تغییرات آنتروپی (ΔS) ، علاوه بر نقشی که در قوانین ترمودینامیک دارد، وارد فسلفه نیز شده است. این مفهوم، باعث شده بسیاری از فلاسفه و دانشمندان باور داشته باشند که جهان هستی به عنوان یک سیستم ترمودینامیکی بسیار بزرگ، همواره به سمت بی نظم تر شدن پیش می رود.

پس از آشنایی با مفاهیم بنیادین، به بررسی قوانین ترمودینامیک خواهیم پرداخت:
قانون صفرم ترمودینامیک
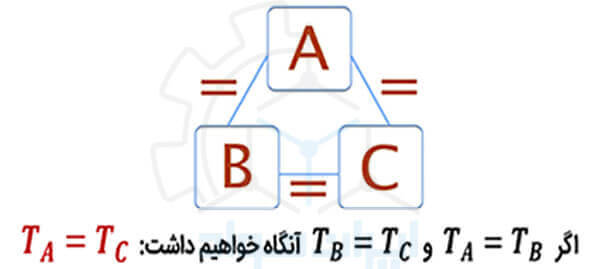
این قانون بیان می کند که اگر دو سیستم با یک سیستم دیگر در تعادل حرارتی باشند (همدما باشند)، آن گاه هر کدام از این سیستم ها با یکدیگر در تعادل اند. این قانون ترمودینامیک، به دما به عنوان یکی از مهم ترین خواص یک سیستم ترمودینامیکی نگاه می کند.
در این قانون، منظور از تعادل حرارتی، شرایطی است که اگر دو سیستم توسط یک دیواره به هم متصل شوند و دیواره در برابر گرما نفوذپذیر باشد، هیچ گرمایی میان دو سیستم رد و بدل نشود.
قانون اول ترمودینامیک
این قانون ترمودینامیک، یک نسخه از قانون پایستگی انرژی است که برای سیستم های ترمودینامیکی بیان شده است. این قانون بیان می کند که انرژی نه می تواند به وجود بیاید و نه از بین برود. برای یک فرایند ترمودینامیکیِ بدون جابجایی ماده، قانون اول ترمودینامیک به شکل زیر فرموله می شود:
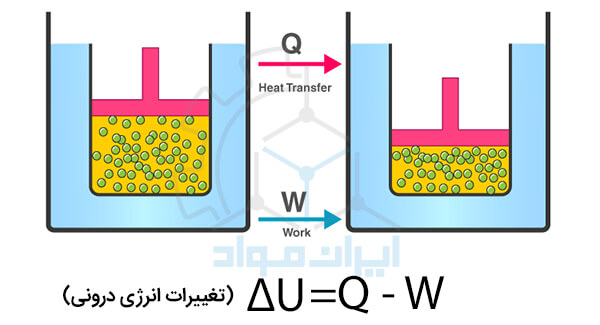
در این رابطه، Q نشان دهنده انرژی وارده به سیستم به صورت گرما است و W نیز کار انجام شده توسط سیستم روی محیط اطراف را نشان می دهد. این قانون ترمودینامیک، نتایج و کاربردهای زیادی در محاسبات چرخه های ترمودینامیکی دارد. در یک چرخه ترمودینامیکی خواهیم داشت:

لازم به ذکر است، کاری که سیستم انجام می دهد، صرفا کار انبساطی نیست. بلکه پارامتری به نام کار اضافی (Extra Work) نیز مطرح است. از این رو می توانیم در این قانون ترمودینامیک، کار را مجموع کار انبساطی و اضافی در نظر بگیریم.
یک مثال از کار اضافی، در مهندسی نانومواد خود را نشان می دهد. با کاهش ابعاد ذرات، سطح آن ها رو به افزایش می رود. کاری که برای ایجاد سطح جدید انجام می شود، یک نوع کار اضافی است. مقدار این کار، از رابطه زیر محاسبه می شود:
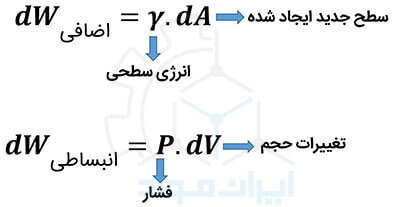
مفاهیمی مانند گرمای ویژه و هدایت حرارتی که پیش از این تعریف شده است، در فرایندهای تبادل گرمایی نقش ویژه ای ایفا می کنند. البته در تعریف این قانون ترمودینامیک، چون سیستم ها تعادلی و ساده در نظر گرفته شده اند، این پارامترها لحاظ نمی شوند. مشخصا برای درک جزئی تر این قانون، ورود این مفاهیم به روابط، اجتناب ناپذیر خواهند بود.
قانون دوم ترمودینامیک
قانون دوم، عجیب ترین و جالب ترین قانون در میان قوانین ترمودینامیک است. این قانون، در مورد برگشت ناپذیری (irreversibility) فرایندهای طبیعی صحبت می کند. به عنوان مثال، حکیم «عمر خیام» در یکی از اشعار خود می گوید:
چون بلبل مست، راه در بستان یافت
روی گل و جام باده را خندان یافت
آمد به زبان حال، در گوشم گفت
دریاب که عمر رفته را نتوان یافت
طبیعتا همه ما با گذشت زمان پیر می شویم و هیچ وقت نمی توانیم عمر خود را مجدد طی کنیم یا این که از زمان پیری به جوانی عمر کنیم. در واقع فرایند طی کردن عمر، فقط در یک جهت طی می شود.
مثال ترمودینامیکی تر این موضوع، در نظر گرفتن یک فنجان قهوه است. بدیهی است که رها کردن یک فنجان قهوه داغ در اتاق، سبب سرد شدن آن خواهد شد.

قانون دوم ترمودینامیک بیان می کند که فرایندهای طبیعی، همواره به سمت یکنواختی فضایی (spatial homogeneity) از ماده، انرژی (و خصوصا دما) می روند.
این بیان باعث می شود که مفهوم آنتروپی در این قانون ترمودینامیک اهمیت ویژه ای پیدا کند. در واقع بسیاری از دانشمندان عقیده دارند این قانون بیان می کند سیستم های ترمودینامیکی، همواره به سمت آنتروپی بیشتر می روند.
با در نظر گرفتن این مفهوم، توصیف علمی قانون دوم به شکل زیر خواهد بود:
«اگر به دو سیستم ایزوله که هر کدام به طور جداگانه در تعادل ترمودینامیکی هستند، اجازۀ برهمکنش دهیم، به یک تعادل ترمودینامیکی مجزای دیگر می رسند. در این صورت، مجموع آنتروپی این سیستم ها در حالت ایزوله، کمتر یا مساوی آنتروپی نهایی پس از برهمکنش است.»
این اصل نیز مانند دیگر قوانین ترمودینامیک، در فرایندهای طبیعی صدق می کند. این فرایندها تماما برگشت ناپذیرند. فرایند برگشت پذیر (Reversible) تنها در تئوری وجود دارد و در حالت طبیعی نمی تواند اتفاق بیفتد. قانون دوم ترمودینامیک، به شکل زیر فرمول بندی شده است.
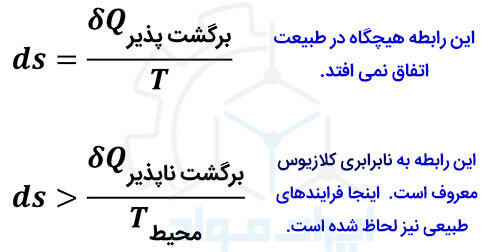
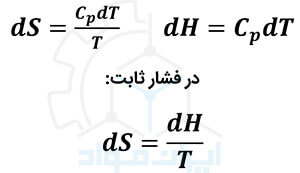
با در نظر گرفتن ظرفیت گرمایی ویژه در فشار ثابت (Cp)، می توان روابط زیر از آنتروپی و آنتالپی را با توجه به نتایج این قانون ترمودینامیک استخراج کرد.
بیان کارنو از قانون دوم
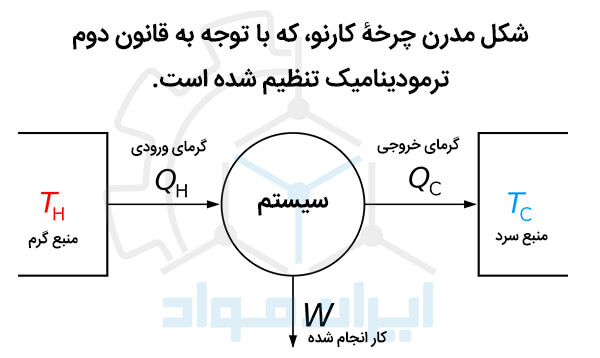
در سال 1824 لئونارد کارنو مدلی برای موتور حرارتی ارائه داد که بعدها با نام چرخه کارنو شناخته شد. این سیکل، روابط میان فشار، حجم و دما را بررسی کرد و نشان داد وقتی مقداری گرما به یک سیستم داده می شود، چگونه به کار تبدیل می شود و چه تغییراتی برای آن به وجود می آید.
اصول این چرخه بیان می کند که فشرده کردن یک گاز دمای آن را افزایش می دهد. این موضوع سبب می شود که این سیستم ترمودینامیکی از محیط اطرافش گرم تر شود. این گرما می تواند با تبادل گرمایی از سیستم ربوده شود.
سپس به سیستم اجازه داده می شود که منبسط و به دنبال آن سرد شود. این همان اساس کار پمپ های حرارتی به کار گرفته شده در یخچال ها و گرمکن هاست.
پمپ وکیوم (پمپ خلا)
اگر تاکنون گذرتان به آزمایشگاه های شیمیایی افتاده باشد، حتما پمپ وکیوم یا خلاء ر...بر عکس، اگر گاز را گرم کنیم، فشارش زیاد می شود و سیستم مجبور می شود خود را منبسط کند. این فشار پیشران می تواند پیستونی را به حرکت وادارد. یعنی انرژی گرمایی به انرژی جنبشی تبدیل شود که این همان اساس کار موتورهای حرارتی است.
بیان امروزی مدل کارنو اذعان می کند که انرژی حرارتی را می توان از یک منبع گرم به یک منبع سرد جاری کرد. آنچه در تعیین مقدار این انرژی موثر است، دمای این منابع است. دیاگرام زیر به خوبی بیان کارنو از ماشین گرمایی را توصیف می کند.
بیان کلوین-پلانک از قانون دوم
طبق این بیان، ساخت یک موتور گرمایی سیکلی که تمام گرمای جذب شده از منبع را به کار روی محیط تبدیل کند، غیرممکن است. در واقع ساخت ماشین حرارتی با بازدهی ۱۰۰ درصد امکان پذیر نیست. همواره مقداری از انرژی ورودی، از طریق فرایندهای طبیعی مانند اصطکاک، غلبه بر ویسکوزیته و… به صورت انرژی تلف شده به منبع سرد داده می شود.
بیان کلازیوس از قانون دوم
طبق این بیان، ساخت یک موتور سیکلی که فقط و فقط گرما را به طور مداوم از دمای سرد دریافت کند و به دمای گرم منتقل کند، غیرممکن است. در واقع امکان ندارد یخچالی ساخته شود که انرژی را از منبع سرد دریافت کند به منبع گرم انتقال دهد، بدون این که کاری از یک منبع دریافت کند.
یخچال های خانگی را در نظر بگیرید. این یخچال ها تا کاری دریافت نکنند، یعنی تا انرژی الکتریکی مصرف نکنند، آب را به یخ تبدیل نمی کنند. شما می توانید انتقال گرما به منبع گرم در یخچال آشپزخانه را با قرار دادن دستتان پشت یخچال به صورت یک باد گرم حس کنید.
قانون سوم ترمودینامیک
این قانون ترمودینامیک، بیان می کند:
«آنتروپی یک کریستال پرفکت و خالص از هر ماده ای در صفر مطلق برابر با صفر است.»
منظور از کریستال پرفکت، یک شبکۀ بلوری بدون نقص است. در صفر مطلق، سیستم در شرایطی با حداقل انرژی حرارتی است. این قانون از رابطۀ زیر منجر می شود:

در صفر کلوین، فقط یک وضعیت برای پیکربندی اتم ها (configuration) ممکن است. بنابراین ln1=0 و آنتروپی برابر با صفر می شود.
طبق این قانون، همه اتفاقات میکروسکوپی در دمای صفر مطلق متوقف می شوند. در این دما تحرک مولکول ها متوقف شده و انرژی جنبشی نیز برابر با صفر می شود. در واقع دیگر هیچ انرژی ای در این دما وجود نخواهد داشت!
بنابراین با نگرشی دیگر می توان گفت هنگامی که انرژی یک سیستم به حداقل مقدار خود میل کند، آنتروپی سیستم به مقدار قابل چشم پوشی می رسد.












دیدگاه کاربران
عالی بود دمتون گرم
دستتون درد نکنه واقعا عالی بود
مرسی دمتون گرم واقعا مقاله ارزشمند و مفیدی بود.
فقط اگه امکانش باشه که کل این مقاله رو در قالب یک فایل PDF بتونیم دانلود کنیم عالی میشه.
تشکر.