
فتوکاتالیست ها پرچمداران حوزه انرژی و محیط زیست!
منظور از فتوکاتالیست چیست؟
واژۀ فتوکاتالیست (Photocatalyst) به کاتالیزورهایی اطلاق می شود که در حضور نور فعال می شوند. بخش عمدۀ این مواد اکسیدهای جامد نیمه هادی هستند که با جذب فوتون های نور، یک جفت الکترون-حفره (Electron-Hole) در آن ها ایجاد می شود. این جفت الکترون-حفره می تواند با مولکول هایی که در سطح این ذرات قرار دارند واکنش داده و کاربردهای خاصی را پدید آورند.
کلمۀ فوتوکاتالیست ریشۀ یونانی دارد و از دو بخش «فوتو» به معنای نور و «کاتالیست» تشکیل شده است. کاتالیست ماده ای است که با شرکت در واکنش های شیمیایی، سرعت آن ها را افزایش می دهد، اما خود دچار تغییر نمی شود و در پایان واکنش مجددا قابل استفاده است. واژه فوتوکالیست نیز از تلفیق دو علم شیمی نور و شیمی کاتالیست به وجود آمده است.
جهت آشنایی با مواد فوتوکاتالیست، لازم است تا با برخی اصطلاحات مهم آشنا شویم:
مفهوم شکاف انرژی (Band Gap)
شکاف انرژی که با نام «بندگپ» نیز شناخته می شود، فاصله بین نوار ظرفیت (Valence Band) و نوار هدایت (conduction band) در پیکربندی الکترونی مواد است. به عبارت ساده تر، بندگپ حداقل انرژی مورد نیاز برای تحریک الکترون از نوار ظرفیت تا نوار هدایت است، جایی که می تواند آزادانه در مسیرهای مرجح جریان پیدا کند. تفاوت در این شکاف انرژی سبب تمایز مواد رسانا، نیمه رسانا و عایق می شود. این فاصله را می توانید در نمودارهای نواری (Band Diagrams) در شکل زیر ملاحظه کنید.
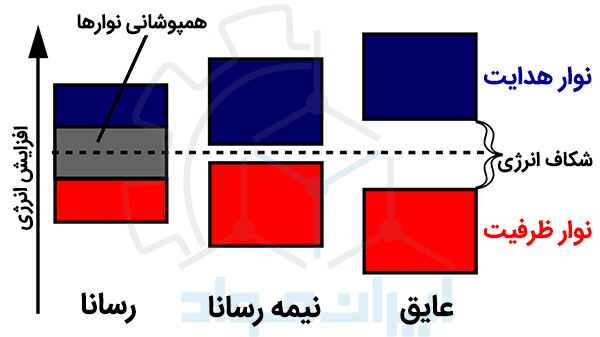
در مواد عایق، الکترون های نوار ظرفیت، با یک شکاف انرژی بزرگ از نوار هدایت جدا شده اند. به همین دلیل نمی توانند مقدار انرژی لازم برای گذار به نوار هدایت را به دست آورند. اما در مواد رسانا، بخشی از نوار ظرفیت با نوار هدایت همپوشانی دارد که باعث جابه جایی کسری از الکترون ها و رسانایی این مواد می شود.
مفهوم الکترون و حفره (Electron & hole)
در قسمت قبل در خصوص سازوکار انتقال الکترونی مواد رسانا و نارسانا صحبت کردیم. اما مواد نیمه رسانا حالتی بینابین دو دسته قبلی دارند. یعنی انرژی در این مواد به اندازه ای کم است که می تواند با نوعی تحریک برطرف شود.
در این حالت، تعداد محدودی الکترون با جذب انرژی می توانند از نوار ظرفیت به هدایت منتقل شوند. به ازای هر الکترون منتقل شده یک حفره با بار مثبت در نوار ظرفیت باقی می ماند. در صورتی که یک الکترون از یک اتم نزدیک بتواند این فضای خالی را پر کند، یک واکنش زنجیره ای بین الکترون ها و حفرات به وجود می آید که اساس کار واکنش های فوتوکاتالیستی است.

بازده کوانتومی
بازده فرایندهای فوتوکاتالیتیک که در مقالات علمی با عنوان «بازده کوانتومی» (Quantom Yield) معرفی می شود، نسبت تعداد الکترون – حفره ایجاد شده بر هر فوتون جذب شده را نشان می دهد. البته توانایی اندازه گیری نور جذب شده واقعی در سیستمهای فوتوکاتالیتیک [به دلیل پراکندگی نور در سطح نیمه رسانا] بسیار دشوار است. از این رو در این حالت معمولا فرض میشود که تمام نور جذب شده است.
در ضمن، اگر چند فرآورده توسط واکنش های فتوکاتالیستی به وجود بیاید، تنها یکی از فرآورده ها مد نظر قرار می گیرد. برای به دست آوردن بازدۀ کوانتومی، بایستی ترکیبی از تمام مسیرهای احتمالی برای الکترون و حفره در نظر گرفته شود. با این فرض؛ می توانیم بازده کوانتومی سیستم را از رابطه زیر محاسبه کنیم:
در این رابطه، نرخ ترکیب مجدد الکترون و حفره هم به ترکیب شدن در سطح و حجم ماده اشاره دارد.
واضح است که بدون ترکیب، بازده کوانتومی برابر 100% خواهد بود. در حالت واقعی ترکیب مجدد همواره اتفاق می افتد و تعداد الکترون ها و حفره ها در سطح یکسان نیست. از این رو تغییرات ابعادی، مهندسی و اصلاحات سطحی مواد فوتوکاتالیست برای افزایش عملکرد آن ها ضروری است.
برای وقوع یک واکنش فوتوکاتالیستی، لازم است تا 4 مرحله اجرا شود:
- جذب انرژی نور برای تولید جفت های الکترون‐حفره
- جدایش بارهای برانگیخته (بار مثبت حفره و بار منفی الکترون)
- انتقال الکترون ها و حفره ها به سطح فوتوکاتالیست
- استفاده از بارهای موجود در سطح برای واکنش های اکسایش و احیا

در مرحله سوم واکنش، بخش بزرگی از جفت های الکترون-حفره، در مسیر حرکت و یا در سطح دوباره ترکیب می شوند. در اثر این ترکیب، انرژی جذب شده الکترون به صورت گرما یا نور آزاد می شود. این اتفاق باعث کاهش بازدهی فتوکاتالیست می شود.
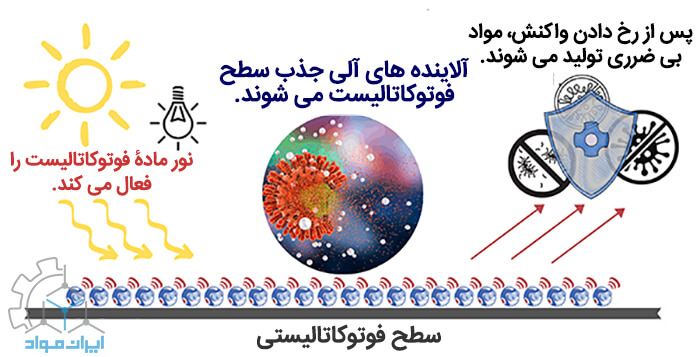
بارهای برانگیخته سطحی که عمر طولانی تری دارند، امکان وقوع واکنش های اکسیداسیون و احیا را فراهم می کنند. آن چه در این فرایند کاتالیز نوری یا Photocatalysis نامیده می شود، برای مثال می تواند تخریب آلاینده های آلی موجود در آب باشد. جایی که پس از جذب نور خورشید (یا نورهای مصنوعی) واکنش تخریب (Degredation) از منظر ترمودینامیکی به صورت خود به خودی انجام می شود. علاوه بر ایجاد میانبر ترمودینامیکی، یک فوتوکاتالیست مسیر واکنش را تغییر می دهد و با این کار، سینتیک واکنش را نیز بهبود می بخشد.
فرایندهای فوتوکاتالیستی موجود
شکل بالا خلاصه ای از رویکردهای فوتوکاتالیستی موجود در طبیعت و صنایع را نشان می دهد. همان طور که مشاهده می کنید، این شکل از 4 بخش تشکیل شده است:
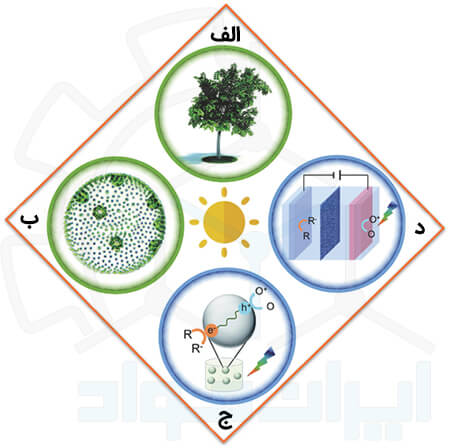
بخش اول: فتوسنتز [موفق ترین عمل کاتالیز نوری طبیعی] را نشان می دهد. این فرایند، به عنوان نتیجۀ هوشمندانه میلیاردها سال تکامل طبیعت، منبع اصلی تأمین انرژی ما بوده است. کربوهیدرات ها محصولات اصلی این واکنش های فوتوکاتالیستی هستند.
بخش دوم: یک نوع ریزجلبک را مشاهده می کنید که طی واکنش هایی مشابه آنچه در گیاهان اتفاق می افتد، مواد شیمیایی بی نظیری را سنتز می کند، نظیر H2، اتانول و گلیسرول. اما وقتی صحبت از سیستم های فتوسنتز مصنوعی می شود، انتخاب های زیادی پیش روی ما وجود دارد.
بخش سوم: فرایندهای کاتالیز نوری مصنوعی را به دو صورت کلی می توان از هم جدا کرد. هنگامی که واکنش های احیا و اکسیداسیون به طور عمدی از هم جدا نشوند، سیستم ارزان قیمتی را می بینیم که در قسمت (ج) نمایش داده شده است. این گروه شامل واکنش های کاتالیزورهای ناهمگن و همگن می شود.
اما یک استراتژی رقابتی برای این حالت این است که مکان های وقوع واکنش های احیا و اکسیداسیون را از نظر فیزیکی جدا کنیم. یعنی آنچه در قسمت (د) مشاهده می کنید. البته لزومی ندارد که برای این کار لزوما از الکترود استفاده کرد و می توان با تمهیدات هوشمندانه، این مکان ها را از هم جدا کرد.
در واقع تفاوت اصلی در سیستم های 3 و 4، جداسازی مکان وقوع واکنش های اکسایش و کاهش است با یک فاصله معقول (بیش از 100 نانومتر) است.
قابلیت تخریب آلاینده توسط کاتالیز نوری به چند عامل بستگی دارد:
ابعاد و مورفولوژی فتوکاتالیست
تمام واکنش های شیمیایی در سطح رخ می دهند. از این رو ابعاد ذره و مورفولوژی کاتالیزگر نوری تأثیر به سزایی در میزان مساحت سطحی و به دنبال آن نرخ تخریب آلاینده ها دارد. پژوهش ها نشان داده اند که مواد نانوساختار با ابعاد کمتر از 20 نانومتر، خواص فیزیکی و شیمیایی بسیار متفاوتی نسبت به مقیاس بالک خود نشان می دهند. بنابراین در این زمینه بسیار مورد توجه هستند.
کاهش اندازه ذرات سبب افزایش شکاف انرژی نیمه هادی ها می شود. اما به طور کلی، با کاهش اندازۀ ذرات، مساحت سطحی ماده فوتوکاتالیست افزایش می یابد و قابلیت بیشتری برای جذب آلاینده ها و فوتون های بیشتر خواهد داشت. بنابراین اثر منفی افزایش شکاف انرژی، از این طریق خنثی می شود.
غلظت آلاینده
مشخص است که مقدار آلاینده ای که می تواند روی سطح مادۀ فوتوکاتالیست جذب شود، تأثیر شگرفی بر واکنش ها دارد. چرا که فقط آلاینده هایی که جذب سطح مادۀ فوتوکاتالیست شوند، قابلیت شرکت در واکنش های فوتوکاتالیستی را دارند. دقت داشته باشید که غلظت آلاینده ای که بهصورت توده ای در تمامی نقاط محلول حضور دارد، نقشی در بازدۀ واکنش ها ندارد.
غلظت مادۀ فوتوکاتالیست
نرخ نابودی آلاینده ها وابستگی شدیدی به میزان غلظت کاتالیزگر نوری دارد. افزایش غلظت مادۀ فوتوکاتالیست، سایت های اکتیو روی سطح این مواد را بیشتر می کند. لذا منجر به تشکیل الکترون-حفره های بیشتر و در نهایت میزان تخریب بیشتر می شود. البته افزایش میزان غلظت هر مادۀ فوتوکاتالیست فقط تا حدی می تواند نرخ تخریب را بهبود بخشد.
دمای واکنش
برای کسب بهترین عملکرد، باید واکنش های فتوکاتالیستی در یک دمای متعادلی انجام شوند. اکثر فوتوکاتالیست ها تا دمای 80 درجه سلسیوس عملکرد بهینه ای دارند. در دماهای بالاتر، علاوه بر افزایش میزان ترکیب مجدد، جذب آلاینده ها روی سطح مادۀ فوتوکاتالیست با خلل مواجه می شود.
از طرفی با کاهش دما تا صفر درجۀ سلسیوس، انرژی اکتیواسیون واکنش ها بالا می رود و راندمان واکنش کاهش می باید. به همین دلیل، بهتر است گسترۀ دمایی 20 تا 80 درجۀ سلسیوس، به عنوان محدودۀ مطلوب برای تخریب نوری آلاینده ها در نظر گرفته شود.
pH محلول
تغییرات pH محلول بارهای سطحی ذرات فوتوکاتالیست و پتانسیل واکنش های کاتالیستی را تغییر می دهد. از این رو این پارامتر، روی شدت جذب سطحی آلاینده موثر است. برای مثال، ذرات TiO2در محیط های اسیدی و قلیایی به ترتیب پروتون دریافت می کنند و از دست می دهند.
یعنی سطح ساختار اکسید تیتانیوم در محیط اسیدی بار مثبت دارد و در محیط قلیایی دارای بار منفی است. لذا نانوذرات TiO2 در محیط اسیدی فعالیت اکسید کنندگی بالاتری از خود نشان می دهند. توجه به این پارامتر در طراحی و پژوهش روی کاتالیزگرهای نوری از ضروریات است.
یون های غیرآلی
در اغلب موارد، آب های آلوده دارای برخی یون های غیرآلی مانند یون های منگنز، آهن، روی، مس، فسفات، نیترات، سولفات و کلراید هستند. این یون ها با جذب سطحی روی مادۀ فوتوکاتالیست بر نرخ تخریب نوری آلاینده های آلی تأثیر می گذارند.
اکسیژن محلول در آب
اکسیژنی که در آب حل شده باشد، در واکنش های فوتوکاتالیستی نقش گیرنده الکترون را دارد. یعنی الکترون برانگیخته شده به نوار هدایت را به دام می اندازد و مانع ترکیب مجدد آن با حفره می شود. طبق تحقیقات، اکسیژن محلول در آب تأثیر چندانی روی میزان جذب آلاینده ها روی سطح کاتالیست TiO2 ندارد.
نیمه هادی های فوتوکاتالیست
نیمه هادی های متنوعی مانند اکسیدهای فلزی و سولفیدی (TiO2، ZnO، Fe2O3، WO3، CdS و SnO2) بهدلیل خواص الکترونی منحصر به فردی که دارند، می توانند به عنوان مواد فتوکاتالیست عمل کنند. این مواد نوار ظرفیت پر و نوار هدایت خالی دارند.
فوتوکاتالیست های نیمه رسانا به دلایل زیر بهترین انتخاب برای تخریب آلاینده های آلی هستند:
- ارزان بودن
- غیرسمی بودن یا سمیت کم داشتن
- انعطاف پذیری خواص
- قابلیت انتقال چندالکترونه (Multielectron transfer process)

در کنار مزایای گفته شده، این فوتوکاتالیست ها محدودیت های خاص خود را دارند، از جمله:
- شکاف انرژی بزرگ که برای تحریک الکترون ها توسط نور نیاز به پرتو فرابنفش دارد.
- ناپایداری در محیط مایع که باعث تجزیه شیمیایی آن ها می شود.
- نرخ بالای ترکیب مجدد الکترون-حفره
ضرورت مهندسی سطح فوتوکاتالیست ها
کاراییِ یک نیمه هادی فوتوکاتالیست با معیارهای مختلفی قضاوت می شود. از جمله:
- پایداری نیمه هادی تحت تابش
- بازده کوانتومی
- درصد گزینشی بودن فرآورده های واکنش
- پاسخ گستره طول موج
- …
برای مثال دو نمونه نیمه هادی CdS و TiO2 را در نظر بگیرید. کادمیم سولفید شکاف انرژی کوچکی دارد و می تواند فوتون های تابشی در محدوده مرئی را جذب کند، اما با گذشت زمان تحت تابش دچار تخریب می شود.
از طرفی، TiO2 یک نیمه هادی کاملا پایدار است، اما از آن جایی که انرژی بندگپ بزرگی دارد (2/3 الکترون ولت)، تنها در محدوده UV فعال است و برای کاربردهای مرئی کارآمد نیست. این در حالی است که تنها نور UV تنها 10% از پرتوهای نور خورشید را شامل می شود.
با اصلاح سطحی می توان بسیاری از محدودیت های نیمه هادی ها را برطرف کرد. 3 مورد از مهم ترین دلایل لزوم اصلاح سطحی در نانوساختارهای فوتوکاتالیستی عبارتند از:
- جلوگیری از ترکیب مجدد به وسیلۀ جداسازی بارهای ایجاد شده
- قابلیت برانگیختگی بندگپ نیمه هادی با نور مرئی
- افزایش گزینشی بودن (Selectivity) فرآورده های واکنش
روش های مختلفی برای اصلاح سطحی نانوساختارهای فوتوکاتالیستی وجود دارد که از این میان می توان به ایجاد ساختارهای کامپوزیتی، ساختارهای هسته-پوسته و تزئین سطحی اشاره کرد.
از فوتوکاتالیست ها برای چه کاربردهایی استفاده می شود؟
همۀ ما در قرن بیست و یکم در برابر چالش های متعدد زیست محیطی و بحران انرژی قرار داریم. در این راستا مواد فوتوکاتالیست که توانایی بهره گیری از انرژی خورشیدی و دیگر منابع نور را دارند، قابلیت فوق العاده ای در کمک رسانی به این نسل و نسل های آینده بشر دارند. ما در این مقاله، کاربرد این مواد را در 4 دسته اصلی تقسیم می کنیم:
تصفیه هوا (Air treatment)
- تصفیه شیمیایی و بیولوژیکی هوای داخلی و خارجی
- از بین بردن بوهای نامطبوع
- از بین بردن اتیلن در هنگام ذخیره سازی میوه ها و سبزیجات
- اصلاح خاک با سلب هوا
- تصفیۀ گازهای خروجی از نیروگاه ها و کارخانه ها
- احیای گاز CO2 و تبدیل آن به گازهای سودمند
تصفیه آب (Water treatment)
- سم زدایی از فاضلاب های شهری و آزمایشگاهی
- تخریب رنگ ها و مواد آلی مضر در آب
- ارائه آب مناسب و تمیز برای مصارف انسانی، کشاورزی یا صنعتی
- تجزیۀ مولکول آب و تولید هیدروژن به عنوان یک سوخت سازگار با محیط زیست
سطوح فعال (Active Surfaces)
- سطوح خود تمیز شونده
- قابلیت استریل خود به خودی در سطوح
- قابلیت تجزیۀ خود به خودی در سطوح
- سطوح ضد مه
شیمی سبز (Green chemistry)
- واکنش های فتوکاتالیزه شده به عنوان مسیرهای مصنوعی تمیزتر و ارزان تر
- به حداقل رسیدن پسماندهای شیمیایی خطرناک

جمع بندی
کاتالیز نوری با فرایندهای کاتالیستی سابقی که با آن آشنایی داشتید متفاوت است. چیزی که باعث این تفاوت می شود، عملکرد نور به عنوان تأمین کنندۀ انرژی لازم برای واکنش های شیمیایی است. فوتوکاتالیست ها بهترین بستر برای واکنش هایی هستند که رخ دادنشان به طور معمول یا دشوار است یا غیر ممکن. دشوار مانند اکسیداسیون آلاینده ها و غیرممکن مانند واکنش احیای کربن دی اکسید.
درک و بهینه سازی خواص فوتوکاتالیست های موجود، سبب بهره گیری بیشتر از مزایای این مواد می شود. با وجود بیش از چهار دهه تلاش مستمر، تحقیقات در حوزۀ مواد فتوکاتالیست هنوز در مراحل ابتدایی خود قرار دارند…
دانلود فقط با IP ایران امکانپذیر است. در صورت عدم مشاهده باکس قرمز رنگ دانلود، VPN خود را خاموش نموده و صفحه را رفرش کنید.
پسورد فایل فشرده : www.iran-mavad.com










دیدگاه کاربران
fبا سلام واحترام . خیلی ممنون بسیار مطالب اموزنده ایی بود.سپاسگزارم
باسلام
ممنون از مطالب مفیدتون خصوصا فتوکاتالیستها