 جدید
جدیدآنتیموان (Antimony)
آنتیموان یک عنصر شیمیایی نیمه فلزی (Semimetallic) است. نوع فلزی انتیموان ظاهری روشن و نقره ای رنگ داشته و سخت و شکننده است. فرم غیر فلزی آن عمدتا به شکل یک پودر خاکستری است. این ماده گاهی در طبیعت به صورت آزاد یافت می شود. اما معمولاً از سنگ معدن زیبای “استبنیت” (Sb2S3) و “والنتینیت” (Sb2O3) بدست می آید.

آنتیموان رسانای ضعیف گرما و برق است. در هوای خشک پایدار است و توسط اسیدهای رقیق یا قلیایی مورد حمله قرار نمی گیرد. نکتۀ جالب در مورد آنتیموان و برخی از آلیاژهای آن این است که در اثر خنک شدن منبسط می شوند!
از آنتیموان بسیار خالص برای ساخت انواع خاصی از دستگاه های نیمه رسانا مانند دیودها و ردیاب های مادون قرمز استفاده می شود. با آلیاژسازی این فلز به همراه سرب، می توان دوام سرب را چندین برابر کرد.
از آلیاژهای انتیموان در باتری ها، فلزات با اصطکاک کم (Low Friction Metals)، کابل و بسیاری محصولات دیگر استفاده می شود. ترکیبات این عنصر نیز برای ساخت مواد ضد شعله، رنگ، مینای دندان سرامیک، شیشه و سفال به کار می رود. مصریان باستان از مادۀ “استبنایت” که حاوی آنتیموان است، به عنوان خط چشم استفاده می کردند.
کشف آنتیموان به چه زمانی بازمی گردد؟
برخلاف بسیاری از فلزات، انتیموان هزاران سال است که توسط انسان استفاده می شود. مصریان باستان حدود 5000 سال پیش، از این فلز در محصولات آرایشی و دارویی استفاده می کردند. پزشکان یونان باستان پودرهای آن را برای درمان اختلالات پوستی تجویز می کردند.

در قرون وسطی نیز آنتیموان فلز مورد علاقۀ کیمیاگران بود. گفته شده است که مرگ “موتزارت” موسیقی دان شهیر در سال 1791 ، در نتیجۀ مصرف بیش از حد داروهای مبتنی بر آنتیموان بوده است. براساس برخی از اولین کتاب های متالورژی در اروپا، روش های اولیه برای جداسازی فلز آنتیموان (Isolating Antimony Metal) احتمالاً توسط شیمی دانان ایتالیایی و بیش از 600 سال پیش شناخته شده بود.
اواسط قرن پانزدهم
یکی از اولین کاربردهای فلزی آنتیموان، در اواسط قرن پانزدهم بود که به عنوان مادۀ سخت کننده در چاپ فلزات با ریخته گری (Cast Metal Printing) مورد استفاده قرار گرفت. این کاربرد در چاپخانه های “یوهانس گوتنبرگ” انجام گرفت. گزارش شده است که تا سال 1500 میلادی، آنتیموان به آلیاژهای مورد استفاده برای تولید ناقوس کلیسا اضافه می شد. زیرا هنگام ضربه زدن، صدای آن خوشایندتر می شده است.
اواسط قرن هفدهم
در اواسط قرن هفدهم، آنتیموان برای اولین بار به عنوان ماده سخت کننده به “پیوتر“ (آلیاژ سرب و قلع) اضافه شد. فلز “بریتانیا” که آلیاژی مشابه پیوتر بوده است، با ترکیب قلع، آنتیموان و مس تولید شد. بریتانیا اندکی پس از پیوتر ساخته شد و اولین تولید آن را به سال 1770 در شهر “شفیلد” انگلیس نسبت می دهند.
بریتانیا قابلیت انعطاف پذیری بیشتری از پیوتر داشت و باید به شکل مورد نظر ریخته گری می شد. همچنین قابلیت شکل دهی به ورق های نوردی، برش و حتی تراش را نیز داشت. از فلز Britannia که تا به امروز نیز استفاده می شود، در ابتدا برای ساخت قوری، لیوان، شمعدان و مقاطع مخروطی استفاده می شد.

سال 1824 میلادی
در حدود سال 1824، یک متالورژیست به نام “آیزاک بابیت” به عنوان اولین تولید کننده ظروف رومیزی ساخته شده از فلز بریتانیا معرفی شد. اما بزرگترین تاثیر وی در ایجاد آلیاژهای آنتیموان، 15 سال بعد بود که شروع به آزمایش آلیاژها به منظور کاهش اصطکاک در موتورهای بخار کرد. در سال 1939، آیزاک آلیاژی متشکل از 4 قسمت مس، 8 قسمت آنتیموان و 24 قسمت قلع ایجاد کرد که بعداً با نام Babbitt شناخته شد.
سال 1784 میلادی
در سال 1784، ژنرال بریتانیایی “هنری شراپلن” یک آلیاژ سرب حاوی 10-13 درصد آنتیموان ایجاد کرد. این آلیاژ به خوبی توانست به شکل گلوله های کروی شکل گرفته و در گلوله های توپخانه ای در سال 1784 مورد استفاده قرار گیرد.
در آن سال انتیموان به عنوان یک فلز جنگی استراتژیک سر زبان ها افتاد. ترکش های ساخته شده با این فلز در طول جنگ جهانی اول به طور گسترده مورد استفاده قرار گرفت. در نتیجه تولید جهانی آن بیش از دو برابر شد و به نقطۀ اوج خود یعنی 82000 تن، در سال 1916 رسید!
پس از جنگ، صنعت اتومبیل سازی در ایالات متحده به مشتری جدیدی برای انتیموان تبدیل شد. جایی که با استفاده از باتری های اسید-سرب (Lead-Acid Batteries) یکسری صفحات آلیاژی سخت و ماندگار تولید شد. هنوز هم باتری های اسید-سرب مصرف بسیاربالایی از آنتیموان فلزی را به خود اختصاص می دهند.
سکه های آنتیموانی در گوئیژو
یکی از اتفاقات تاریخی جالب مربوط به انتیموان، به اوایل دهۀ 1930 بازمی گردد. در آن سال، دولت محلی استان “گوئیژو” در کشور چین، سکه هایی از جنس آلیاژ سرب-آنتیموان تولید کرد. گزارش شده است که در حدود نیم میلیون سکه در گوئیژو ریخته گری شد. اما بعدا مشخص شد که این سکه ها نرم و مستعد خراب شدن و صدالبته سمی بودند! از این رو به زودی از بازار جمع شدند و تولید این سکه ها متوقف شد.
مروری بر خواص فلز آنتیموان
پایدارترین شکل آنتیموان عنصری، ماده ای شکننده و نقره ای با درخشش فلزی بالا است. رسوب الکترولیتی آنتیموان در شرایط خاص نوعی شکل ناپایدار و آمورف را ایجاد می کند که “آنتیموان انفجاری” نامیده می شود. زیرا در صورت خم شدن یا خراشیدن، به صورت انفجاری ملایم به شکل فلزی با ثبات تر تغییر می یابد.
یک نوع انتیموان سیاه آمورف نیز وجود دارد که در اثر کوئنچ ناگهانی از فاز بخار تولید می شود. یک فرم زرد رنگ از این فلز نیز مشاهده شده که به دلیل اکسیداسیون دمای پایین مادۀ “استیبین” با فرمول شیمیایی SbH3 درهوا یا کلر ایجاد می شود.
آنتیموان فلزی در شرایط عادی تحت تأثیر هوا و رطوبت قرار نمی گیرد. اما اگر هوا مرطوب باشد به تدریج اکسید می شود. آنتیموان هنگام گرمایش به راحتی توسط گوگرد و هالوژن ها اکسید می شود. هنگامی که در هوا گرم می شود، با شعلۀ آبی درخشان می سوزد و بخارهای سفید تری اکسید با فرمول شیمایی Sb2O3 را تشکیل می دهد. تری اکسید آنتیموان هم در اسیدها و هم در مواد قلیایی محلول است.

ساختار الکترونیکی آنتیموان تقریباً شبیه آرسنیک است و دارای سه اوربیتال نیمه پر در خارجی ترین پوستۀ خود است. بنابراین می تواند سه پیوند کووالانسی ایجاد کند و حالت های اکسیداسیون +3 و -3 را تشکیل دهد.
الکترونگاتیویتی انتیموان، مانند آرسنیک، تا حدودی بحث برانگیز است. به طور کلی توافق شده است که این پارامتر در این عنصر کمتر از آرسنیک است. اما اینکه از فسفر نیز کمتر باشد، قطعی نیست.
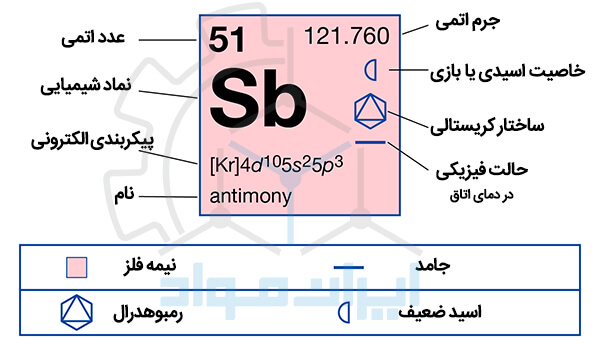
این عنصر می تواند به عنوان یک مادۀ اکسید کننده عمل کند و با بسیاری از فلزات واکنش دهد. در نتیجه آنتیمونیدهایی (Antimonides) را تشکیل می دهد که به طور کلی شبیه نیتریدها، فسفیدها و آرسنیدها هستند. اما تا حدودی فلزی نیز هستند. ارتقای یکی از الکترون های جفت نشده به یک اوربیتال d خارجی ظاهراً در آنتیموان راحت تر از آرسنیک اتفاق می افتد. زیرا آنتیموان حالت اکسیداسیون 5+ را در تشکیل ترکیبات “پنتافلوراید” و “پنتاکلراید” از خود نشان می دهد. جدول زیر خلاصه ای از خواص و مشخصات انتیموان را لیست کرده است.

توزیع و فراوانی آنتیموان
فراوانی آنتیموان در زمین تقریباً یک پنجم عنصر آرسنیک است. یعنی به طور متوسط حدود یک گرم در هر تُن پوستۀ زمین، یافت می شود. از نظر کیهانی، تخمین زده می شود به ازای هر 5،000،000 اتم سیلیکون، یک اتم آنتیموان وجود داشته باشد.
انتیموان دو ایزوتوپ پایدار دارد که از نظر فراوانی تقریباً برابر هستند و در طبیعت یافت می شوند. جرم یکی 121 و دیگری 123 است. ایزوتوپ های رادیواکتیو این عنصر دارای جرم های 120 ، 122 ، 124 ، 125 ، 126 ، 127 ، 129 و 132 هستند که عمدتا به صورت مصنوعی تولید می شوند.
امروزه رسوبات بسیار کمی از فلز خالص انتیموان یافت می شود. در واقع بیشتر فراوانی و توزیع آنتیموان، در قالب بیش از 100 مادۀ معدنی است. اگر یادتان باشد گفتیم که مهمترین آن ها سنگ معدن “استبنیت” (Sb2S3) و “والنتینیت” (Sb2O3) است.
ذخایر کوچک استبنیت در الجزایر، بولیوی، چین، مکزیک، پرو، آفریقای جنوبی و در مناطقی از شبه جزیرۀ بالکان یافت می شود. سنگ های دیگری که تولید انتیموان از آن ها ارزش اقتصادی داشته باشد عبارتند از:
- کرمزیت (2Sb2S3 · Sb2O3)
- تتراهدریت ارگانیفرس ((Cu,Fe)12 Sb4S13)
- لیوینگستونیت (HgSb4S7)
- جامسونیت (Pb4FeSb6S14)
مقادیر کمی انتیموان نیز از فرایند تولید مس و سرب قابل بازیابی است. تقریباً نیمی از آنتیموان تولیدی، از آلیاژ قراضۀ سرب حاصل از باتری های قدیمی بازیافت می شود. این عنصر برای تأمین سختی به باتری های قدیمی اضافه می شد.
استخراج آنتیموان به چه صورتی انجام می شود؟
سنگ استبنیت با گرید بالا (یا غنی شده از انتیموان) مستقیماً با آهن قراضه در حالت مذاب واکنش می دهد و باعث آزاد شدن فلز آنتیموان می شود. این فرایند در دمای 500 تا 600 درجۀ سلسیوس انجام می گیرد. بنابراین به طور کلی، آنتیموان را می توان با تبدیل استنبنیت به اکسید و به دنبال آن احیا با کربن (کک) بدست آورد. واکنش های شیمیایی اصلی که در این فرایند روی می دهد به صورت زیر است.
Sb2S3 + 3Fe → 2Sb + 3FeS
2Sb2S3+ 3C → 4Sb + 3CO2
محلول های سولفور سدیم، عامل لیچینگ موثری برای افزایش غلظت استیبنیت هستند. در واقع الکترولیز همین محلول هاست که باعث تولید آنتیموان می شود. همان طور که در واکنش ها مشخص است، در ابتدا سولفید به اکسید تبدیل می شود. سپس محصول پخته می شود. در نهایت آنتیموان با احیای کربوترمال از اکسید جدا می شود.
پس از پالایش بیشتر آنتیموان خام، فلز حاصل که Regulus نامیده می شود، به صورت کیک ریخته گری می شود. استخراج آنتیموان از سنگ معدن تا حدود زیادی به کیفیت و ترکیب سنگ معدن بستگی دارد. اکثر انتیموان تولیدی به صورت سولفید استخراج می شود. سنگ معدن های گرید پایین را نیز می توان با فرایند شناورسازی تغلیظ کرد.
ذخایر جهانی آنتیموان
سازمان زمین شناسی انگلیس (BGS) گزارش داده که در سال 2005 چین با داشتن حدود 84 درصد از سهم جهانی، بهترین تولید کنندۀ آنتیموان بوده است. پس از آن آفریقای جنوبی، بولیوی و تاجیکستان قرار داشتند. معدن Xikuangshan در استان “هونان” چین با تخمین ذخایر 2.1 میلیون متری بیشترین ذخایر این فلز را در چین دارد.
در سال 2016، مطابق سازمان زمین شناسی ایالات متحده، چین 76.9 درصد از کل تولید جهانی آنتیموان را از آن خود کرده است. پس از آن روسیه با 6.9 درصد و تاجیکستان با 6.2 درصد، در جایگاه دوم قرار دارند.
انتظار می رود در آینده تولید آنتیموان در چین کاهش یابد. زیرا معادن و کارخانه های ذوب معدنی، به عنوان بخشی از سیاست کنترل آلودگی توسط دولت تعطیل می شوند. به خصوص به دلیل اجرای قانون جدید حفاظت از محیط زیست که در ژانویۀ 2015 تصویب شده است.
طبق گزارش پایگاه Roskill، حدود ده سال است که هیچ معدن قابل توجهی از آنتیموان در چین ساخته نشده است و بقیۀ ذخایر اقتصادی این فلز نیز به سرعت در حال تخلیه هستند.
اما در ایران …
مهم ترین معدن آنتیموان در ایران، معدن “سفیدآبه” است. این معدن در فاصلۀ 300 کیلومتری شمال غرب زاهدان در استان سیستان و بلوچستان احداث شده است. بهرهبردار و دارندۀ پروانۀ بهرهبرداری این معدن، “شرکت تهیه و تولید مواد معدنی ایران” است.
ذخیرۀ قطعی این معدن براساس پروانۀ بهره برداری، 4500 تن کانسنگ آنتیموان با عیار 37 درصد است. البته باتوجه به گزارش ارزیابی مجدد ذخایر، گزارشاتی مبنی بر افزایش ذخیره از 5000 به 25000 تن شده است. استخراج اسمی سالیانۀ کانسنگ بر اساس پروانۀ بهرهبرداری در زمان راه اندازی معدن و کارخانه، برابر با 500 تن کانسنگ بوده است.

75 میلیارد ریال سرمایه گذاری در این معدن شده است که زمینۀ اشتغال 25 نفر را فراهم نموده است. 50 نفر نیز در کارخانۀ تولید شمش انتیموان در شمال شرق زاهدان مشغول به کار هستند. تاریخ افتتاح و راه اندازی خط استخراج و کارخانۀ فرآوری آنتیموان سفیدآبه در اردیبهشت سال 95 بوده است.
مدیر واحد آنتیموان سفیدآبه اظهار می کند که با مطالعات آزمایشگاهی که روی شمش تولیدی آنتیموان انجام شده است، در نهایت محصولی با عیار ۹۸/۹۹ درصد به دست آمد که با استاندارد جهانی برابری می کند. معدن انتیموان “تربت جام” نیز دومین معدن مهم این فلز در ایران است. این معدن در 45 كيلومتری شمال غرب تربت جام و در روستای چشمه جوهر قرار دارد. گسترۀ اين محدودۀ معدنی 10.3 كيلومتر مربع است. ذخيرۀ قطعی اين معدن 12 هزار تن آنتيموان، ميزان استخراج سالانه آن هزار و 500 تن و نوع سنگ آن، كانی سولفيد آنتيموان در سنگ بستر كربناته با عيار 25 درصد است.
از آنتیموان برای چه کاربردهایی استفاده می شود؟
آلیاژها و ترکیبات انتیموان
تقریباً نیمی از آنتیموان تولیدی در مصارف متالورژیکی مصرف می شود و عمدتا در آلیاژها به کار می رود. از آنجا که برخی از آلیاژهای آنتیموان در حین انجماد منبسط می شوند، به عنوان یک فلز ریختگی دارای ارزش هستند.

انبساط آلیاژ، فلز را مجبور خواهد کرد شکاف های کوچک قالب های ریخته گری را پر کند. علاوه بر این، وجود انتیموان در آلیاژهایی که شامل سرب و مقادیر کمی قلع باشند، سختی آلیاژ را افزایش می دهد.
این عنصر حتی اگر با مقدار کم به فلزاتی نظیر سرب نیز اضافه شود، استحکام و سختی را افزایش می دهد. آلیاژهایی که تشکیل می شود را می توان به طور گسترده در صفحات باتری اتومبیل، گلوله ها، پوشش کابل ها و تجهیزات شیمیایی مانند مخازن و لوله ها به کار گرفت.
انتیموان آلیاژهای ضد اصطکاکی به نام بابیت (babbitt) را تشکیل می دهد که در اجزای یاتاقان های ماشین استفاده می شوند. همچنین به همراه قلع، آلیاژهایی مانند بریتانیا و پیوتر را که برای ظروف استفاده می شود، تشکیل می دهد.
از این عنصر به عنوان آلیاژ لحیم کاری نیز استفاده می شود. از انواع بسیار خالص آن در فناوری نیمه هادی برای تهیه ترکیبات بین فلزی با ایندیم، آلومینیوم و آنتیمونید گالیوم برای دیودها و ردیاب های مادون قرمز استفاده می شود.
[Advert id=”121″]
از ترکیبات آنتیموان (به خصوص تریاکسید) به عنوان مواد بازدارندۀ آتش در رنگ ها، پلاستیک ها، انواع لاستیک و منسوجات به طور گسترده ای استفاده می شود. از چندین ترکیب دیگر آنتیموان به طور مستقل به عنوان رنگدانه استفاده می شود.
مادۀ Tartar Emetic که یک نمک آلی آنتیموان است، در صنایع نساجی برای کمک به اتصال برخی از رنگ ها به پارچه و در پزشکی به عنوان مادۀ خلط آور و تهوع آور استفاده می شود.
بازدارنده های آتش و شعله
یکی از کاربردهای معمول آنتیموان، استفاده به صورت تری اکسید برای کاربردهای ضد شعله است. این عنصر همیشه در کنار بازدارنده های هالوژنه (Halogenated Flame Retardants) استفاده می شود. البته به جز پلیمرهای حاوی هالوژن.
اثر بازدارندگی تری اکسید آنتیموان، در اثر تشکیل ترکیبات هالوژنۀ آنتیموان به وجود می آید. این عنصر با اتم های هیدروژن و احتمالاً با اتمهای اکسیژن و رادیکال های OH واکنش نشان می دهد و در نهایت باعث مهار آتش می شود.

اصلی ترین بازارهای این نوع بازدارنده های آتش، شامل مبلمان، لباس کودکان، اسباب بازی ها، هواپیماها و روکش صندلی های اتومبیل است. همچنین برای مواردی مانند روکش موتور هواپیماهای سبک، بازدارنده های آنتیموانی به رزین های پلی استر در کامپوزیت های فایبرگلاس اضافه می شود. البته باید توجه کرد که این رزین در حضور شعلۀ خارجی می سوزد. اما با برداشته شدن شعله، خاموش می شود و سوزندگی آن ادامه نمی یابد.
زیست شناسی و پزشکی
در زیست شناسی و پزشکی کاربردهای کمی برای آنتیموان گزارش شده است. آنتیموان و ترکیبات آن در چندین داروی دامپزشکی مانند “آنتیومالین” و “تیومالات آنتیموان لیتیم” به عنوان نرم کنندۀ پوست در نشخوارکنندگان استفاده می شود. آنتیموان یک سری اثرات مُغَذی بر روی بافت های کراتینه شده در حیوانات دارد.
دیگر داروهای مبتنی بر آنتیموان، مانند “مگلومین آنتیمونیات” نیز به عنوان داروهای انتخابی برای درمان بیماری سالک در حیوانات اهلی استفاده می شوند. از نظر تاریخی، پودر حاصل از آنتیموان خرد شده (سرمه) با استفاده از میله فلزی و چاشنی بر روی چشم زده می شود.
قدیمی ها تصور می کردند این سرمه در بهبود عفونت های چشم کمک می کند. این عمل هنوز در یمن و سایر کشورهای مسلمان دیده می شود. از آنتیموان برای درمان عفونت های انگلی نیز استفاده می شود.
کاربردهای دیگر
یکی از کاربردهای شیمایی انتیموان، استفاده به عنوان تثبیت کننده و کاتالیزور برای تولید “پلی اتیلن ترفتالات” (Polyethylene Terephthalate) است. مورد دیگر، استفاده به عنوان یک عاملریزکننده (Fining Agent) برای از بین بردن حباب های میکروسکوپی در شیشه است. این کاربرد بیشتر برای تولید صفحه های تلویزیون مدرن استفاده می شود.
آثار بیولوژیکی و سمّی انتیموان
آنتیموان و تعدادی از ترکیبات آن بسیار سمی هستند. در حقیقت، استفاده از ترکیبات آنتیموان برای اهداف دارویی به دلیل تعداد تلفاتی که ایجاد کرد، چند قرن پیش به طور موقت غیرقانونی اعلام شد.
از معدود ترکیباتی که در حال حاضر در پزشکی انسان به عنوان خلط آور، برافروزان و تحریک کننده استفاده می شود، مادۀ Tartar Emetic است که پیش از این نام بردیم. لازم به ذکر است امروزه این دارو کم کم با دارویی تحت عنوانPraziquantel جایگزین می شود. حداکثر غلظت قابل تحمل گرد و غبار آنتیموان در هوا تقریباً مانند آرسنیک است که 0.5 میلی گرم در هر متر مکعب گزارش شده است.
افرادی که با آنتیموان کار می کنند، با تنفس در غبارهای حاوی این عنصر ممکن است آسیب ببینند. قرار گرفتن در معرض آنتیموان توسط انسان می تواند با تنفس هوا، نوشیدن آب و خوردن غذاهای حاوی آن صورت گیرد. تنفس آنتیموان که در فاز گازی به هیدروژن متصل باشد، اثرات منفی زیادی روی سلامتی خواهد داشت.
قرار گرفتن در معرض غلظت نسبتاً زیاد این عنصر (9 میلی گرم در هر متر مکعب هوا) برای مدت زمان طولانی می تواند باعث تحریک چشم، پوست و ریه ها شود. با ادامۀ تماس، ممکن است اثرات جدی تری روی سلامتی مانند بیماری های ریوی، مشکلات قلبی، اسهال، استفراغ شدید و زخم معده رخ دهد.
هنوز به طور دقیق اثبات نشده است که آیا آنتیموان می تواند باعث سرطان یا نارسایی تولید مثل شود. افرادی که مقدار زیادی از داروهای حاوی این عنصر را مصرف کرده اند یا به آن حساس بوده اند، دچار مشکل شده اند.
منابع
Grund, Sabina C.; Hanusch, Kunibert; Breunig, Hans J.; Wolf, Hans Uwe (2006) “Antimony and Antimony Compounds” in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a03_055.pub2
“Antimony Statistics and Information” (PDF). National Minerals Information Center. USGS.
Kiehne, Heinz Albert (2003). “Types of Alloys”. Battery Technology Handbook. CRC Press. pp. 60–61. ISBN 978-0-8247-4249-2.
Ipser, H.; Flandorfer, H.; Luef, Ch.; Schmetterer, C.; Saeed, U. (2007). “Thermodynamics and phase diagrams of lead-free solder materials”. Journal of Materials Science: Materials in Electronics. 18 (1–3): 3–17. doi:10.1007/s10854-006-9009-3. S2CID 85452380
Shotyk, W.; Krachler, M.; Chen, B. (2006). “Contamination of Canadian and European bottled waters with antimony from PET containers”. Journal of Environmental Monitoring. 8 (2): 288–92. doi:10.1039/b517844b
www.britannica.com










دیدگاه کاربران